题目内容
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,1.12LCCl4含有C-Cl键数目为0.2NA |
B.标准状况下,2.24L氯气中含有的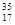 Cl数目一定为0.2NA Cl数目一定为0.2NA |
| C.常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA |
| D.80mL 10mol·L-1盐酸与足量MnO2加热反应,产生Cl2分子数为0.2NA |
C
解析试题分析:A、CCl4为液态,不能用气体摩尔体积计算,错误;B、天然的氯元素有2种同位素,其总量为0.2NA,错误;C、CO2与N2O摩尔质量相同,分子中原子个数相同,故原子个数为4.4÷44×3=0.3mol,正确;D、该反应中盐酸为浓盐酸,随反应进行盐酸浓度降低不再反应,故产生的Cl2分子数小于0.2NA,错误。
考点:考查阿伏加德罗常数有关问题。

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
下列各项中的两个分子核外电子总数不同的是( )
| A.H2O2和CH3OH | B.HNO2和HClO |
| C.H2O和CH4 | D.HCl和F2 |
自瑞士ETH天文研究所的Ansgar Grimberg等的研究结果表明,太阳气体中存在大量的20Ne和22Ne。下列关于20Ne和22Ne的说法正确的是
| A.20Ne和22Ne互为同位素 | B.20Ne和22Ne是同一种核素 |
| C.20Ne的原子核中有20个质子 | D.22Ne的原子核中有22个中子 |
设NA表示阿伏加德罗常数。下列叙述正确的是
| A.常温常压下,22 g CO2中含有NA个C=O键 |
| B.标准状况下,将22.4L氯化氢气体溶于足量水中,溶液中含有的氯化氢分子数为NA |
| C.常温常压下,22.4 L N2和O2的混合气体中含有的分子数目为NA |
| D.9 g重水含有的电子数为5 NA |
用NA表示阿伏加德罗常数的值。下列判断正确的是
| A.常温常压下,2 g H2含氢原子数为NA |
| B.标准状况下,32 g SO2的体积约为11.2 L |
| C.0.1 mol·L-1 NaNO3溶液中含有的钠离子数为NA |
| D.标准状况下,22.4 LH2O含有的氢原子数为2NA |
NA为阿伏加德罗常数,下列说法正确的是
| A.1 mol碳正离子(CH3+)所含的电子总数为9NA |
| B.28g乙烯所含共用电子对数目为4NA |
| C.标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA |
| D.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是:
| A.甲的分子数比乙的分子数多 |
| B.甲的物质的量比乙的物质的量少 |
| C.甲的摩尔体积比乙的摩尔体积小 |
| D.甲的相对分子质量比乙的相对分子质量小 |