题目内容
【题目】钴及其化合物在磁性材料、电池材料、超硬材料及催化剂等领域有广泛应用.
(1)CoxNi(1-x)Fe2O4可用作H2O2分解的催化剂
①已知CoxNi(1-x)Fe2O4中Co、Ni化合价均为+2,则该化合物这铁元素的化合价为_______
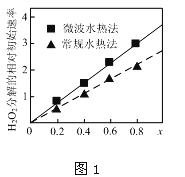
②如图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线.由图中信息可知:_______法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是__________
③CoxNi(1-x)Fe2O4能与氢碘酸发生氧化还原反应,所得溶液这含有三种金属离子,写出反应的离子方程式____________
(2)草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
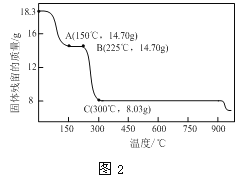
① 通过计算确定C点剩余固体的化学式为________
② 取一定质量二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比为______________。
(3)以硫化钴(Co3S4)为原料冶炼钴的原理为在空气中焙烧矿石得到两种氧化物,反应中只有一种元素被氧化,然后利用铝热反应可得到钴。写出焙烧时的化学方程式:________;写出铝热反应的引发操作_______。
【答案】 +3 微波水热法 Co2+ CoxNi(1-x)Fe2O4+8H++2I-=xCo2++(1-x)Ni2++2Fe2++I2+4H2O Co3O4 5:6 Co3S4 + 6O2 = Co3O4 +4SO2 在铝热剂表面铺一层氯酸钾,插上镁条,点燃镁条
【解析】(1)①CoxNi(1-x)Fe2O4中Co、Ni均为+2,O为-2价,则Fe的化合价为![]() =+3;
=+3;
②过氧化氢的分解速率越大,催化剂活性更高,根据图象可知,x相同时,微波水热法初始速度大于常规水热法,故微波水热法制得催化剂的活性更高;由图可知,随x值越大,过氧化氢的分解速率越大,而x增大,Co2+的比例增大,故Co2+的催化活性更高;
③CoxNi(1-x)Fe2O4能与氢碘酸发生氧化还原反应,I-应被氧化为I2,Fe3+被还原为Fe2+,同时得到Co2+、Ni2+,结合电子守恒、电荷守恒及原子守恒得此反应的离子方程式为CoxNi(1-x)Fe2O4+8H++2I-=xCo2++(1-x)Ni2++2Fe2++I2+4H2O;
(2)①由图可知,CoC2O42H2O的质量为18.3g,其我知道可为0.1mol,Co元素质量为5.9g,C点钴氧化物质量为8.03g,氧化物中氧元素质量为8.03g-5.9g=2.13g,则氧化物中Co原子与O原子物质的量之比为0.1mol∶![]() ≈3∶4,故C点剩余固体为Co3O4;B点对应物质的质量为14.7g,与其起始物质的质量相比减少18.3g-14.7g=3.6g,为结晶水的质量,故B点物质为CoC2O4,与氧气反应生成Co3O4与二氧化碳,反应方程式为:3CoC2O4+2O2
≈3∶4,故C点剩余固体为Co3O4;B点对应物质的质量为14.7g,与其起始物质的质量相比减少18.3g-14.7g=3.6g,为结晶水的质量,故B点物质为CoC2O4,与氧气反应生成Co3O4与二氧化碳,反应方程式为:3CoC2O4+2O2![]() Co3O4+6CO2;
Co3O4+6CO2;
②由电子守恒:n(Co3+)=2 n(Cl2)=2×![]() =0.4 mol,
=0.4 mol,
由电荷守恒:n(Co原子)总=n(Co2+)溶液=![]() n(Cl-)=
n(Cl-)=![]() ×( 0.48L×5mol/L-2×
×( 0.48L×5mol/L-2×![]() )=1 mol,所以固体中的n(Co2+)=1mol-0.4mol=0.6 mol,
)=1 mol,所以固体中的n(Co2+)=1mol-0.4mol=0.6 mol,
根据化合价电荷守恒为0,氧化物中n(O)=(0.6mol×2+0.4mol×3)÷2=1.2mol,
故该钴氧化物中n(Co)∶n(O)=1mol:1.2mol=5∶6;
(3)硫化钴(Co3S4)在空气中焙烧得到两种氧化物,反应中只有一种元素被氧化,则定有SO2,Co的化合价不发生改变,其对应的氧化产物为Co3O4,故焙烧时的化学方程式Co3S4 + 6O2 = Co3O4 +4SO2;引发铝热反应的操作为在铝热剂表面铺一层氯酸钾,插上镁条,点燃镁条。

