题目内容
【题目】[物质结构与性质]K4[Fe(CN)6]强热可发生反应:
3 K4[Fe(CN)6] ![]() 2 (CN)2↑+12 KCN +N2↑+ Fe3C + C
2 (CN)2↑+12 KCN +N2↑+ Fe3C + C
(1)K4[Fe(CN)6]中Fe2+的配位数为 (填数字);Fe2+基态外围电子排布式为 。
(2)(CN)2分子中碳原子杂化轨道类型为 ;1molK4[Fe(CN)6]分子中含有![]() 键的数目为 。
键的数目为 。
(3)O![]() 与CN
与CN![]() 互为等电子体,则O
互为等电子体,则O![]() 的电子式为 。
的电子式为 。
(4)Fe3C的晶胞结构中碳原子的配位数为6,碳原子与紧邻的铁原子组成的空间构型为 。
【答案】(1)6;3d6; (2)sp;12mol; (3)![]() ;(4)正八面体。
;(4)正八面体。
【解析】
试题分析:(1)此化合物属于配合物,CN-属于配体,即Fe2+的配位数是6,铁元素属于第四周期,VIII族元素,价电子排布式为3d64s2,因此Fe2+外围排布式为3d6;(2)(CN)2中C和N之间有1个σ键,C的孤电子对数=(4-3)/2=0.5,价层电子对数为2,杂化轨道数=价层电子对数,即C的杂化类型是sp,配位键属于σ键,因此1mol此物质有σ键的物质的量为2×6mol=12mol;(3)等电子体的结构相同,C和N之间共用3个电子对,因此O22+的电子式为![]() ;(4)碳原子的配位数为6,说明C原子紧邻的铁原子有6个,
;(4)碳原子的配位数为6,说明C原子紧邻的铁原子有6个,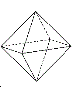 ,6个顶点是铁原子,C原子位于体心,因此构型为正八面体。
,6个顶点是铁原子,C原子位于体心,因此构型为正八面体。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
