题目内容
7.能正确表示下列反应的离子方程式的是( )| A. | NO2与水反应:3NO2+H2O═2NO3-+NO+2H+ | |
| B. | 向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+═SO2↑+H2O | |
| C. | 氨水吸收NO、NO2:NO+NO2+2OH-═2NO2-+H2O | |
| D. | NH4HCO3溶于过量浓NaOH溶液中:NH4++OH-═NH3↑+H2O |
分析 A.二者反应生成硝酸和一氧化氮;
B.硝酸具有强的氧化性,能够氧化亚硫酸根离子生成硫酸根离子;
C.一水合氨为弱碱,应保留化学式;
D.氢氧化钾过量,反应生成碳酸钠、氨气和水.
解答 解:A.NO2与水反应,离子方程式:3NO2+H2O═2NO3-+NO+2H+,故A正确;
B.酸性条件下,亚硫酸钠被硝酸氧化生成硫酸钠,离子反应方程式为:3SO32-+2H++2NO3-=3SO42-+2NO↑+H2O,故B错误;
C.用氨水吸收废气中氮的氧化物的离子反应为NO+NO2+2NH3.H2O═2NH4++2NO2-+2H2O,故C错误;
D.NH4HCO3溶于过量的浓NaOH溶液,反应的离子方程式为:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O,故D错误;
故选:A.
点评 本题考查了离子方程式的书写判断,为高考的高频题,掌握离子方程式的书写原则,明确离子方程式正误判断常用方法是解题关键,注意化学式拆分、注意离子反应遵循客观事实,题目难度中等.

练习册系列答案
相关题目
10.下列各项中表述正确的是( )
| A. | CO2的分子模型示意图: | B. | F-的离子结构示意图: | ||
| C. | CO2的电子式: | D. | N2的结构式 |
2.1.52g 铜镁合金完全溶解于 50mL 密度为 1.40g/mL、质量分数为 63%的浓硝酸中,得到 NO2 和 N2 O4的混合气体 1120 mL(标准状况),向反应后的溶液中加入 1.0 mol/L NaOH 溶 液,当金属离子全部沉淀时,得到 2.54g 沉淀.下列说法不正确的是( )
| A. | 该合金中铜与镁的物质的量之比是 2:1 | |
| B. | 该浓硝酸中 HNO3 的物质的量浓度是 14.0 mol/L | |
| C. | NO2 和 N2 O4 的混合气体中,NO2 的体积分数是 80% | |
| D. | 得到 2.54 g 沉淀时,加入 NaOH 溶液的体积是 600 mL |
12.在1.013×105Pa下,测得的某些烷烃的沸点见下表.据表分析,下列选项正确的是( )
| 物质名称 | 沸点/℃ |
| 正丁烷CH3(CH2)2CH3 | -0.5 |
| 正戊烷CH3(CH2)3CH3 | 36.1 |
异戊烷  | 27.8 |
新戊烷 | 9.5 |
| 正己烷CH3(CH2)4CH3 | 69.0 |
| A. | 在标准状况时,新戊烷是气体 | |
| B. | 在1.013×105Pa、20℃时,C5H12都是液体 | |
| C. | 烷烃随碳原子数增加,沸点降低 | |
| D. | C5H12随支链增加,沸点降低 |
19.下列离子方程式书写正确的是( )
| A. | 向漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| B. | 氢氧化钠溶液中通入过量的二氧化硫:SO2+OH-=HSO3- | |
| C. | 碳酸氢钙溶液中加足量的氢氧化钠溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| D. | 稀硫酸和氢氧化钡溶液:Ba2++SO42-═BaSO4↓ |
16.下列说法能体现羟基对苯环影响的是( )
| A. | 苯酚溶液显弱酸性 | |
| B. | 苯酚比苯容易发生溴代反应 | |
| C. | 苯酚能与NaOH溶液反应,而苯甲醇不能与NaOH溶液反应 | |
| D. | 苯不溶于水,而苯酚能溶于水 |
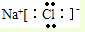 .
. 已知:2NaOH+Cl2=NaClO+NaCl+H2O.标准状况下,H2和 Cl2的混合气体共2.24L,光照充分反应后,用NaOH充分吸收.
已知:2NaOH+Cl2=NaClO+NaCl+H2O.标准状况下,H2和 Cl2的混合气体共2.24L,光照充分反应后,用NaOH充分吸收.