题目内容
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol
H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol
H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中CO 的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和小于1
CD
【解析】此题先将文字信息转化成图表。
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)  H<0
H<0
Ⅰ(mol) 1 1 0 0 平衡后容器温度升高(T1>700℃)
Ⅱ(mol) 0 0 1 1 平衡后容器温度降低(T2<700℃)
Ⅲ(mol) 2 2 0 0 平衡后容器温度升高(T3>T1>700℃)
容器是恒容的绝热体系,与外界没有热量交换。容器Ⅰ、Ⅲ反应都向右进行,容器温度会升高,正反
应放热,温度升高会抑制正反应进行的程度,同时容器Ⅲ起始投料是Ⅰ的两倍,因此平衡后T3>T1>700℃。而容器Ⅱ反应向左进行,容器温度会降低,也会抑制向左进行的程度,同时T2<700℃<T1。
三个容器先假设在相同的温度下反应(恒温下),容器Ⅰ和Ⅱ达到平衡后,此时是完全的等效平衡;
因为该反应是等体积反应,容器Ⅰ和Ⅲ投料比相同,平衡后则也是等效平衡。然后再对容器Ⅰ和Ⅲ升温,对容器Ⅱ降温,则容器Ⅰ和Ⅲ平衡向左移,容器Ⅱ平衡向右移,此时三个容器平衡后都不等效了。
达到平衡后,A项,容器Ⅰ的温度比Ⅱ高,反应速率也要快。B项,平衡后容器Ⅲ的温度要比容器Ⅰ要高,所以平衡常数不相等,且Ⅰ>Ⅲ。C项,恒温时,容器Ⅰ和Ⅱ完全等效,两个容器中的CO的物质的量相等,再到绝热体系,对容器Ⅰ升温,对容器Ⅱ降温,Ⅰ平衡向左移,容器Ⅱ平衡向右移,平衡后CO的物质的量,Ⅰ>Ⅱ,C项正确。D项,恒温时,容器Ⅰ和Ⅱ完全等效,容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和等于1,再到绝热体系,对容器Ⅰ升温,对容器Ⅱ降温,Ⅰ平衡向左移,容器Ⅱ平衡向右移,容器Ⅰ中CO的转化率减小,容器Ⅱ中CO2的转化率也减小,则容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小1,D项正确。
【考点定位】本题考查化学平衡移动原理及其应用。难度很大。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案| A、容器甲、丙中,逆反应的速率:v(甲)=v(丙) | B、容器甲、乙中,HI 的物质的量:n(甲)<n(乙) | C、容器甲、乙中有关反应物的转化率:α(H2)+α(HI)<100% | D、容器甲、乙中,化学平衡常数:K(甲)=K(乙) |
| A、容器Ⅰ、Ⅱ中正反应速率相同 | B、容器Ⅰ、Ⅲ中反应的平衡常数相同 | C、容器Ⅰ中CO的物质的量比容器Ⅱ中的多 | D、容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和等于1 |
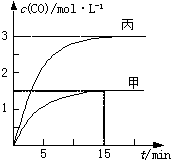 一定条件下存在反应:C(s)+H2O(g)═CO(g)+H2(g)△H>0.向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图.
一定条件下存在反应:C(s)+H2O(g)═CO(g)+H2(g)△H>0.向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图.| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | V |
| 温度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2molC 1molH2O |
1molCO 1molH2 |
4molC 2molH2O |
| A、甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol?L-1?min-1 |
| B、丙容器的体积V<0.5 L |
| C、当温度为T1℃时,反应的平衡常数K=2.25 |
| D、乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2 |