题目内容
一定条件下存在反应:CO(g)+H2O(g)?CO2(g)+H2(g),其正反应放热.现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1mol CO和1mol H2O,在Ⅱ中充入1mol CO2和1mol H2,在Ⅲ中充入2mol CO 和2mol H2O,700℃条件下开始反应.达到平衡时,下列说法正确的是( )
| A、容器Ⅰ、Ⅱ中正反应速率相同 | B、容器Ⅰ、Ⅲ中反应的平衡常数相同 | C、容器Ⅰ中CO的物质的量比容器Ⅱ中的多 | D、容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和等于1 |
分析:A.两个容器中平衡建立的途径不相同,无法比较反应速率;
B.平衡常数K只与温度有关,Ⅰ、Ⅲ两个容器恒容绝热,反应物的量不同反应的热效应不同,体系温度不同;
C.容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中的基础上降低温度,平衡向正反应移动,所以容器Ⅰ中CO 的物质的量比容器Ⅱ中的多;
D.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1.
B.平衡常数K只与温度有关,Ⅰ、Ⅲ两个容器恒容绝热,反应物的量不同反应的热效应不同,体系温度不同;
C.容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中的基础上降低温度,平衡向正反应移动,所以容器Ⅰ中CO 的物质的量比容器Ⅱ中的多;
D.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1.
解答:解:A.两个容器中平衡建立的途径不相同,无法比较反应速率建立平衡途径不同,无法比较反应速率,故A错误;
B.Ⅰ、Ⅲ两个容器恒容绝热,反应物的量不同反应的热效应不同,所以平衡常数K不同,故B错误;
C.容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中的基础上降低温度,平衡向正反应移动,所以容器Ⅰ中CO 的物质的量比容器Ⅱ中的多Ⅰ中CO的物质的量和容器Ⅱ中的多,故C正确;
D.如果温度相同时,容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和等于1,因为容器绝热,容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中的基础上降低温度,平衡向正反应移动,二氧化碳的转化率比两容器相同温度时容器Ⅱ中CO2的转化率低,所以容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和小于1,故D错误.
故选C.
B.Ⅰ、Ⅲ两个容器恒容绝热,反应物的量不同反应的热效应不同,所以平衡常数K不同,故B错误;
C.容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中的基础上降低温度,平衡向正反应移动,所以容器Ⅰ中CO 的物质的量比容器Ⅱ中的多Ⅰ中CO的物质的量和容器Ⅱ中的多,故C正确;
D.如果温度相同时,容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和等于1,因为容器绝热,容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中的基础上降低温度,平衡向正反应移动,二氧化碳的转化率比两容器相同温度时容器Ⅱ中CO2的转化率低,所以容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和小于1,故D错误.
故选C.
点评:本题主要考查了化学平衡的建立与等效平衡的关系,需要注意的是容器绝热,反应放热,温度升高,学生易错.

练习册系列答案
相关题目
在一定条件下存在反应:I2(g)+H2(g)?2HI(g),其正反应放热.现有3个相同的2L恒容绝热(与外界没有热量交换)密闭容器甲、乙、丙,在甲中充入1mol I2(g)和1mol H2(g),在乙中充入2mol HI(g),在丙中充入2mol I2(g)和2mol H2(g),在一定温度下下开始反应.达到平衡时,下列说法不正确的是( )
| A、容器甲、丙中,逆反应的速率:v(甲)=v(丙) | B、容器甲、乙中,HI 的物质的量:n(甲)<n(乙) | C、容器甲、乙中有关反应物的转化率:α(H2)+α(HI)<100% | D、容器甲、乙中,化学平衡常数:K(甲)=K(乙) |
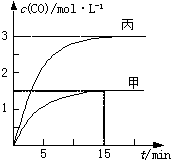 一定条件下存在反应:C(s)+H2O(g)═CO(g)+H2(g)△H>0.向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图.
一定条件下存在反应:C(s)+H2O(g)═CO(g)+H2(g)△H>0.向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图.| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | V |
| 温度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2molC 1molH2O |
1molCO 1molH2 |
4molC 2molH2O |
| A、甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol?L-1?min-1 |
| B、丙容器的体积V<0.5 L |
| C、当温度为T1℃时,反应的平衡常数K=2.25 |
| D、乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2 |