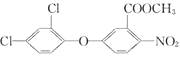
题目内容
【题目】在0.10mol·L-1NH3·H2O溶液中,加入少量NH4Cl晶体后,引起的变化是
A.NH3·H2O的电离程度减小
B.NH3·H2O的电离常数增大
C.溶液的导电能力不变
D.溶液的pH增大
【答案】A
【解析】
A.向氨水中加入氯化铵晶体,铵根离子浓度增大,抑制NH3H2O电离,则NH3H2O电离程度减小,故A正确;
B.NH3H2O的电离常数只受温度的影响,温度不变,则平衡常数不变,故B错误;
C.加入少量NH4Cl晶体后,溶液离子浓度增大,则导电能力增强,故C错误;
D.加入少量NH4Cl晶体后,NH4+离子浓度增大,平衡向逆向移动,c(OH-)变小,pH减小,故D错误;
故选:A。

练习册系列答案
相关题目
【题目】以苯甲醛为原料,通过Cannizzaro反应来制备苯甲醇和苯甲酸,反应式为:
主反应:
副反应:![]()
主要物料的物理常数如表:
名称 | 分子量 | 性状 | 相对密度 | 沸点 | 溶解度 | |
水 | 乙醚 | |||||
苯甲醛 | 106 | 无色液体 | 1.04 | 179 | 微溶 | 易溶 |
苯甲酸 | 122 | 无色晶体 | 1.27 | 249 | 0.21g | 66g |
苯甲醇 | 108 | 无色液体 | 1.04 | 205 | 微溶 | 易溶 |
乙醚 | 74 | 无色液体. | 0.71 | 35 | 不溶 | ﹣﹣ |
实验步骤: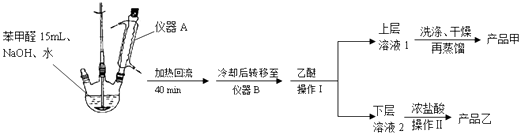
(1)仪器A的作用是 .
(2)蒸馏操作时温度应该控制在左右.获得产品乙时进行的操作Ⅱ的名称是 .
(3)①上层溶液1中除乙醚外主要有机杂质是、 .
洗涤时先后用到了饱和NaHSO3溶液、10%的NaHCO3溶液和水.
②洗涤操作在中进行.
a.烧杯 b.布氏漏斗 c.烧瓶 d.分液漏斗
③加入10%的NaHCO3溶液至(填现象)时说明杂质已被除尽.
(4)若产品甲的质量为5.40g,则产品甲的产率是 .