题目内容
【题目】(1)常温下,已知0.1mol﹒L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8。
① 常温下,0.1 mol﹒L-1 HA溶液的pH=_________;设计一个简单实验证明HA是强酸还是弱酸_________。
② pH=3的HA与pH= 11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:______________。
(2)常温下,向pH=a的氨水中加入等体积盐酸时,溶液呈中性,则此盐酸的pH______________14—a (>、<、=)
(3)向物质的量浓度均为0.01 mol﹒L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的离子是______________,当两种难溶电解质共存时,溶液中c(Ba2+)/c(Mn2+) 。
(此温度下,Ksp(BaCO3)=8.1×10-9、Ksp(MnCO3)=1.8×10-11)
(4)己知常温下CH3COOH的电离平衡常数为1.7×10-5,则该温度下CH3COO-的水解平衡常数等于____________(保留小数点后两位数字)。
【答案】(1)①3(2分)测NaA溶液的PH值,如果等于7,则为强酸,大于7为弱酸(其他合理答案也可)(2分)②c(A-)>c(Na+)>c(H+)>c(OH-)(2分)
(2)<(2分)(3)Mn2+(2分),450(2分)(4)5.88×10-10(2分)
【解析】
试题分析:(1)①常温下,已知0.1mol·L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8,则根据水的离子积常数可知c(OH-)=10-11mol/L,所以氢离子浓度是0.001mol/L,则pH=3;可以通过相应的钠盐是否水解判断酸是否是强酸还是弱酸,因此实验方案为测NaA溶液的pH值,如果等于7,则为强酸,大于7为弱酸;
②pH=11的NaOH溶液中c(OH-)=10-3mol·L-1,HA是弱酸,酸的浓度远远大于氢离子浓度,所以pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中的溶质是酸和盐,溶液呈酸性,所以溶液中氢离子浓度大于氢氧根离子浓度,酸根离子浓度大于钠离子浓度,溶液中4种离子物质的量浓度大小关系是c(A-)>c(Na+)>c(H+)>c(OH-)。
(2)假设氨水是强电解质时,pH=a的氨水中氢氧根离子浓度=10a-14mol·L-1,向pH=a的氨水中加入等体积盐酸时,溶液呈中性,则氢氧根离子浓度等于氢离子浓度,所以盐酸的pH=14-a;实际上氨水是弱碱,等体积的酸和碱混合后溶液呈中性,说明酸的浓度大于碱的浓度,则盐酸的pH<14-a;
(3)碳酸钡的溶度积常数大于碳酸锰的溶度积常数,所以锰离子先沉淀;当两种难溶电解质共存时,则
c(CO32-)=c(Mn2+)=![]() ,溶液中c(Ba2+)=
,溶液中c(Ba2+)=![]() ,c(Ba2+):c(Mn2+)=
,c(Ba2+):c(Mn2+)=![]() :
:![]() =450;
=450;
(4)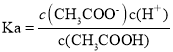 ,
,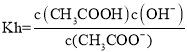 ,Kw=c(H+)·c(OH-),所以Kh=Kw/Ka=5.88×10-10。
,Kw=c(H+)·c(OH-),所以Kh=Kw/Ka=5.88×10-10。

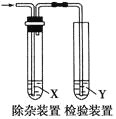
【题目】用下图所示装置检验乙烯时不需要除杂的是 ( )
乙烯的制备 | 试剂X | 试剂Y |
| |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 | |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 | |
C | C2H5OH与浓H2SO4加热至170℃ | 资*源%库NaOH溶液 | KMnO4酸性溶液 | |
D | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
A. A B. B C. C D. D
【题目】下表是元素周期表的一部分,请回答有关问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素是______。(用元素符号表示)
(2)②③④三种元素的原子半径从大到小的顺序是______(用元素符号表示)
(3)用电子式表示③与⑦形成化合物的过程_______________________。
(4)在①~⑧元素中,元素的最高价氧化物对应的水化物中碱性最强的___。(填化学式)
(5)在⑦与⑩的单质中,化学性质较活泼的是_____。(填化学式)