题目内容
 对于反应N2O4(g)
对于反应N2O4(g) 2NO2(g)在温度一定时,平衡体系中NO2的体积分数
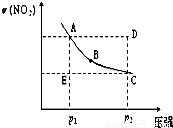
2NO2(g)在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上任何一点为对应压强下的平衡点),下列说法正确的是( )
分析:N2O4(g) 2NO2(g)在温度一定时,平衡体系中NO2的体积随压强的增大而减小,平衡向逆反应方向移动,处于曲线上的点为不同压强下的平衡状态,D、E为达到平衡状态,可与平衡状态的浓度比较判断平衡移动的方向.
2NO2(g)在温度一定时,平衡体系中NO2的体积随压强的增大而减小,平衡向逆反应方向移动,处于曲线上的点为不同压强下的平衡状态,D、E为达到平衡状态,可与平衡状态的浓度比较判断平衡移动的方向.
 2NO2(g)在温度一定时,平衡体系中NO2的体积随压强的增大而减小,平衡向逆反应方向移动,处于曲线上的点为不同压强下的平衡状态,D、E为达到平衡状态,可与平衡状态的浓度比较判断平衡移动的方向.
2NO2(g)在温度一定时,平衡体系中NO2的体积随压强的增大而减小,平衡向逆反应方向移动,处于曲线上的点为不同压强下的平衡状态,D、E为达到平衡状态,可与平衡状态的浓度比较判断平衡移动的方向.解答:解:A.压强越大,反应速率越大,则A、C两点的正反应速率的关系为A<C,故A错误;
B.E点的NO2的体积分数小于平衡状态,达到平衡,NO2的体积分数应增大,反应向正反应方向移动,则v(正)>v(逆),故B错误;
C.使E状态到达A状态,应是平衡向正反方向移动,可由C点减小压强得到,故C正确;
D.压强越大反应速率越大,则达到平衡用时越小,x>y,故D错误.
故选C.
B.E点的NO2的体积分数小于平衡状态,达到平衡,NO2的体积分数应增大,反应向正反应方向移动,则v(正)>v(逆),故B错误;
C.使E状态到达A状态,应是平衡向正反方向移动,可由C点减小压强得到,故C正确;
D.压强越大反应速率越大,则达到平衡用时越小,x>y,故D错误.
故选C.
点评:本题考查化学平衡图象问题,题目难度中等,本题注意把握图象曲线的特点以及压强对平衡移动的影响,易错点为C,注意体会平衡移动的特点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 对于反应N2O4(g)
对于反应N2O4(g) 2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是( )
2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是( )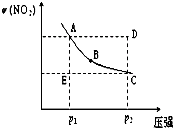 (2009?汕头二模)对于反应N2O4(g)
(2009?汕头二模)对于反应N2O4(g)  2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是( )
2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是( )
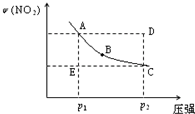
 2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是( )
2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是( )