题目内容
 对于反应N2O4(g)
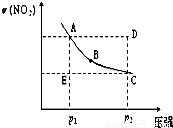
对于反应N2O4(g) 2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是( )
2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是( )分析:根据C点对应的压强大于A点的压强,来分析正反应速率;利用A、B、C三点都在平衡线上,所以此三点的正逆反应速率相等.D点要达到平衡,必须降低NO2的百分含量,也就是使平衡向逆反应方向移动,从而得出v(正)<v(逆).E点要达到平衡,必须提高NO2的质量分数,也就是使平衡向正反应方向移动,从而得出v(正)>v(逆);由图可知AE与DC线段的长度相等,也就是NO2的体积变化量相等.但由于D点的压强大于E点的压强,所以D点的反应速率大于E点的反应速率,故所需时间x>y;对于压强的改变,当快速加压时,平衡未移动,但压强迅速增大,反映在图象上就是纵坐标不变,横坐标不断增大;当缓慢加压时,平衡不断地被破坏,但又不断地建立新的平衡,所以缓慢加压时,NO2的体积分数的变化应不断地在平衡曲线上滑动.所以“使E状态从水平方向到达C状态”,应突然加压;“由C沿平衡曲线以达A状态”,应缓慢降压.
解答:解:A、对于有气体参加的化学反应,压强越大,反应速率越大,由于C点对应的压强大于A点的压强,所以正反应速率vA<vC,故A错;
B、在图象中,A、B、C三点都在平衡线上,所以此三点的正逆反应速率相等,E点要达到平衡,必须提高NO2的质量分数,也就是使平衡向正反应方向移动,从而得出v(正)>v(逆),故B错;
C、压强越大反应速率越大,因D点的压强大于E点的,所以D点的反应速率大于E点的反应速率,故所需时间x>y,故C错;
D、当快速加压时,平衡未移动,当缓慢加压时,平衡不断地被破坏,但又不断地建立新的平衡,所以“使E状态从水平方向到达C状态”,应突然加压;“由C沿平衡曲线以达A状态”,应缓慢降压.故D正确.
故选D.
B、在图象中,A、B、C三点都在平衡线上,所以此三点的正逆反应速率相等,E点要达到平衡,必须提高NO2的质量分数,也就是使平衡向正反应方向移动,从而得出v(正)>v(逆),故B错;
C、压强越大反应速率越大,因D点的压强大于E点的,所以D点的反应速率大于E点的反应速率,故所需时间x>y,故C错;
D、当快速加压时,平衡未移动,当缓慢加压时,平衡不断地被破坏,但又不断地建立新的平衡,所以“使E状态从水平方向到达C状态”,应突然加压;“由C沿平衡曲线以达A状态”,应缓慢降压.故D正确.
故选D.
点评:本题考查压强对化学反应速率以及化学平衡移动的影响,注意分析个位置的状态,易错点为D项.

练习册系列答案
 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
 对于反应N2O4(g)
对于反应N2O4(g) 2NO2(g)在温度一定时,平衡体系中NO2的体积分数
2NO2(g)在温度一定时,平衡体系中NO2的体积分数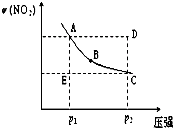 (2009?汕头二模)对于反应N2O4(g)
(2009?汕头二模)对于反应N2O4(g)  2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是( )
2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是( )
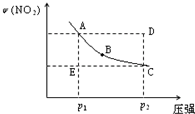
 2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是( )
2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是( )