题目内容
下列叙述正确的是
| A.对于平衡体系:H2(g)+I2(g)==2HI(g),其它条件不变时,增大体系压强,平衡向正反应方向移动,体系颜色加深 |
| B.—定温度下,物质的量浓度相同的4种溶液①CH3COONa②NaNO3③Na2CO3④NaOH,pH的大小顺序是④>③>①>② |
| C.0.1mol?L-1的氨水加水稀释后,NH3?H2O的电离程度增大,c(OH-)增大,c(H+)减小 |
| D.常温下,c(H+)/c(OH-)=10-10的溶液中:Na+、Al3+、SO-2-、NO3-可大量共存 |
A
试题分析:A、增大体系压强,I2的浓度增大,体系颜色加深但方程式两边气体分子数相同,平衡不移动,错误;B、NaOH是强碱,而CH3COONa、Na2CO3水解使溶液呈碱性,且越弱越水解,NaNO3是强酸强碱盐溶液定为中性,pH的大小顺序是④>③>①>②,正确;C、氨水加水稀释后,NH3?H20的电离程度增大,c(OH-)减小,c(H+)增大,错误;D、c(H+)/(OH-)=10-10,溶液呈碱性,Al3+不能存在,故错误。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

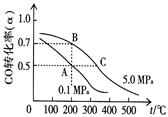
 2SO3(g)。下列说法不正确的是
2SO3(g)。下列说法不正确的是 4NO(g)+6H2O(g)ΔH=-akJ/mol(a﹥0)
4NO(g)+6H2O(g)ΔH=-akJ/mol(a﹥0)
 CO(g)+H2(g)?131.4 kJ。
CO(g)+H2(g)?131.4 kJ。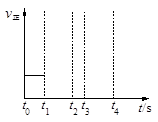
 2Z(g) △H<
2Z(g) △H< ,如图是反应达平衡及改变条件平衡移动的图像。下列说法错误的是
,如图是反应达平衡及改变条件平衡移动的图像。下列说法错误的是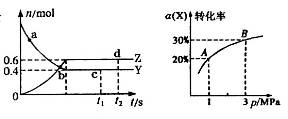
 CO(g)+3H2(g) △H=+206.0kJ?molˉ1
CO(g)+3H2(g) △H=+206.0kJ?molˉ1
 2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
 4NO(g)+6H2O(g)
4NO(g)+6H2O(g) 2C(g)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法,其中正确的是( )
2C(g)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法,其中正确的是( )