题目内容
PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,10 min时达到平衡:PCl3(g) + Cl2(g)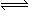 PCl5(g)有关数据如下,下列判断不正确的是
PCl5(g)有关数据如下,下列判断不正确的是
|
|
PCl3(g) |
Cl2(g) |
PCl5(g) |
|
初始浓度(mol/L) |
2.0 |
1.0 |
0 |
|
平衡浓度(mol/L) |
c1 |
c2 |
0.4 |
A.10 min内,v(Cl2) = 0.04 mol/(L·min)
B.当容器中Cl2为1.2 mol时,反应达到平衡
C.若升高温度(T1<T2)时,该反应平衡常数减小,则平衡时PCl3的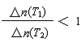
D.平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L
C
【解析】
试题分析:
PCl3(g) + Cl2(g)
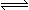 PCl5(g)
PCl5(g)
起始浓度: 2.0 1.0 0
转化: 0.4 0.4 0.4
平衡浓度: 1.6 0.6 0.4
A、10 min内,v(Cl2) = 0.04 mol/(L·min),正确;B、当容器中Cl2为1.2 mol时,此时Cl2浓度为0.6 mol/L。反应达到平衡,正确;C、若升高温度(T1<T2)时,该反应平衡常数减小,表明该反应正向为放热反应,高温时PCl3的浓度改变量小,则平衡时PCl3的
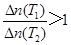 ,正确;D、平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L,正确。
,正确;D、平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L,正确。
考点:电解质的有关知识。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案(2012?朝阳区一模)PCl3和PCl5都是重要的化工原料.将PCl3(g) 和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下发生下述反应,并于10min时达到平衡:PCl3(g)+Cl2(g)?PCl5(g),有关数据如下:
|
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度/(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度/(mol/L) | c1 | c2 | 0.4 |
| A、10 min内,v(Cl2)=0.04 mol/(L?min) |
| B、当反应达到平衡时,容器中Cl2为1.2 mol |
| C、若升高温度反应的平衡常数减小,则平衡时PCl3的转化率变大 |
| D、平衡后再加入2.0 mol PCl3,在相同条件下再达平衡时,c(PCl5)<1.0mol/L |
PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生反应,在10 min时达到平衡:PCl3(g)+Cl2(g)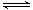 PCl5(g)。有关数据如下:
PCl5(g)。有关数据如下:
|
|
PCl3(g) |
Cl2(g) |
PCl5(g) |
|
初始浓度/(mol/L) |
2.0 |
1.0 |
0 |
|
平衡浓度/(mol/L) |
c1 |
c2 |
0.4 |
下列判断错误的是
A.10 min内,v(Cl2)=0.04 mol/(L·min)
B.当反应达到平衡时,容器中Cl2为1.2 mol
C.若升高温度反应的平衡常数减小,则平衡时PCl3的转化率变大
D.平衡后再加入2.0 mol PCl3,在相同条件下再达平衡时,c(PCl5)<1.0mol/L
PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,并于10 min时达到平衡:PCl3(g)+Cl2(g)  PCl5(g) △H<0。有关数据如下:
PCl5(g) △H<0。有关数据如下:
|
|
PCl3(g) |
Cl2(g) |
PCl5(g) |
|
初始浓度/(mol/L) |
2.0 |
1.0 |
0 |
|
平衡浓度/(mol/L) |
(1.6)c1 |
(0.6)c2 |
0.4 |
下列判断不正确的是( )
A.10 min内,v(Cl2)=0.04 mol/(L·min)
B.当容器中Cl2为1.2 mol时,反应达到平衡
C.升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大
D.平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,
c(PCl5)<0.2 mol/L