题目内容
(2012?朝阳区一模)PCl3和PCl5都是重要的化工原料.将PCl3(g) 和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下发生下述反应,并于10min时达到平衡:PCl3(g)+Cl2(g)?PCl5(g),有关数据如下:
|
分析:A.由表中数据可知,平衡时△c(PCl5)=0.4mol/L,根据方程式可知△c(PCl3)=0.4mol/L,根据v=
计算v(PCl3);
B.平衡时△c(PCl5)=0.4mol/L,根据方程式可知△c(Cl2)=0.4mol/L,根据△n=△c×V计算△n(Cl2),进而计算平衡时Cl2的物质的量;
C.升高温度,反应的平衡常数减小,平衡向逆反应移动;
D、平衡后移走2.0mol PCl3和1.0mol Cl2到达的平衡,等效为开始PCl3为1mol/L、Cl2为0.5mol/L到达平衡,与原平衡相比,压强降低,平衡向逆反应移动,反应物转化率降低.
| △c |
| △t |
B.平衡时△c(PCl5)=0.4mol/L,根据方程式可知△c(Cl2)=0.4mol/L,根据△n=△c×V计算△n(Cl2),进而计算平衡时Cl2的物质的量;
C.升高温度,反应的平衡常数减小,平衡向逆反应移动;
D、平衡后移走2.0mol PCl3和1.0mol Cl2到达的平衡,等效为开始PCl3为1mol/L、Cl2为0.5mol/L到达平衡,与原平衡相比,压强降低,平衡向逆反应移动,反应物转化率降低.
解答:解:A.由表中数据可知,平衡时△c(PCl5)=0.4mol/L,根据方程式可知△c(PCl3)=0.4mol/L,v(PCl3)=
=0.04mol?L-1?min-1,故A正确;
B.平衡时△c(PCl5)=0.4mol/L,根据方程式可知△c(Cl2)=0.4mol/L,△n(Cl2)=0.4mol/L×2L=0.8mol,故平衡时Cl2的物质的量为1mol/L×2L-0.8mol=1.2mol,故B正确;
C.升高温度,反应的平衡常数减小,平衡向逆反应移动,PCl3转化率降低,△n减小,故平衡时PCl3的
>1,故C错误;
D、平衡后移走2.0mol PCl3和1.0mol Cl2到达的平衡,等效为开始PCl3为1mol/L、Cl2为0.5mol/L到达平衡,反应物的浓度变为原平衡的一半,与原平衡相比,压强降低,平衡向逆反应移动,反应物转化率降低,故相同条件下再达平衡时,c(PCl5)<0.2 mol?L-1,故D正确;
故选C.
| 0.4mol/L |
| 10min |
B.平衡时△c(PCl5)=0.4mol/L,根据方程式可知△c(Cl2)=0.4mol/L,△n(Cl2)=0.4mol/L×2L=0.8mol,故平衡时Cl2的物质的量为1mol/L×2L-0.8mol=1.2mol,故B正确;
C.升高温度,反应的平衡常数减小,平衡向逆反应移动,PCl3转化率降低,△n减小,故平衡时PCl3的
| △n(T1) |
| △n(T2) |
D、平衡后移走2.0mol PCl3和1.0mol Cl2到达的平衡,等效为开始PCl3为1mol/L、Cl2为0.5mol/L到达平衡,反应物的浓度变为原平衡的一半,与原平衡相比,压强降低,平衡向逆反应移动,反应物转化率降低,故相同条件下再达平衡时,c(PCl5)<0.2 mol?L-1,故D正确;
故选C.
点评:本题考查化学平衡常数的应用、化学平衡的有关计算等,难度中等,注意D选项中构建平衡建立的途径.

练习册系列答案
相关题目
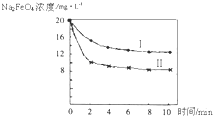 (2012?朝阳区一模)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂.工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
(2012?朝阳区一模)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂.工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下: