题目内容
(16分)某化学兴趣小组需制备22.4 LSO2气体(标准状况),他们依据化学方程式Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓硫酸(ρ=1.84 g/cm3)110mL充分反应,待锌粒全部溶解后,收集所得气体X。经测定其中含有气体杂质。
ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓硫酸(ρ=1.84 g/cm3)110mL充分反应,待锌粒全部溶解后,收集所得气体X。经测定其中含有气体杂质。
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是 (填分子式)。产生这种结果的主要原因是(用离子方程式表示) 。
(2)为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体(X)取样进行认真探究。
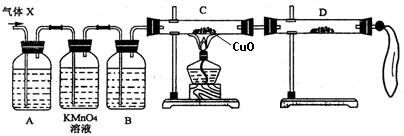
①组装好仪器后,盛放药品前,必要的一个操作是 。
②A中加入的试剂可能是 ,作用是 。
B中加入的试剂可能是 ,作用是 。
③证实气体X中混有较多杂质气体,应观察到C中的实验现象是 ,D中最好选择的试剂是 。
(3)假定气体在吸收过程吸收完全,对上述装置略加改进,可以粗略测定X气体中SO2的体积分数。改进时可选用的下列仪器为 (填代号)。
a.导管 b.水槽 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
 ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓硫酸(ρ=1.84 g/cm3)110mL充分反应,待锌粒全部溶解后,收集所得气体X。经测定其中含有气体杂质。
ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓硫酸(ρ=1.84 g/cm3)110mL充分反应,待锌粒全部溶解后,收集所得气体X。经测定其中含有气体杂质。(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是 (填分子式)。产生这种结果的主要原因是(用离子方程式表示) 。
(2)为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体(X)取样进行认真探究。

①组装好仪器后,盛放药品前,必要的一个操作是 。
②A中加入的试剂可能是 ,作用是 。
B中加入的试剂可能是 ,作用是 。
③证实气体X中混有较多杂质气体,应观察到C中的实验现象是 ,D中最好选择的试剂是 。
(3)假定气体在吸收过程吸收完全,对上述装置略加改进,可以粗略测定X气体中SO2的体积分数。改进时可选用的下列仪器为 (填代号)。
a.导管 b.水槽 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
(本题共16分)
(1)主要杂质气体可能是 H2 (填分子式)。(1分)
产生这种结果的主要原因是(用离子方程式表示)Zn + 2H+ = H2↑+ Zn2+ (2分)
(2)①必要的一个操作是检查装置的气密性(2分)
②A中加入的试剂可能是:品红试液(1分),作用是证实SO2的存在(2分)。
B中加入的试剂可能是:浓硫酸(1分),作用是干燥氢气(2分)。
③应观察到C中的实验现象是:固体由黑色变成红色(2分),D中最好选择的试剂是:固体无水硫酸铜(1分)。
(3)改进时可选用的下列仪器为 a、c、e、g (填代号)。(2分)
(1)主要杂质气体可能是 H2 (填分子式)。(1分)
产生这种结果的主要原因是(用离子方程式表示)Zn + 2H+ = H2↑+ Zn2+ (2分)
(2)①必要的一个操作是检查装置的气密性(2分)
②A中加入的试剂可能是:品红试液(1分),作用是证实SO2的存在(2分)。
B中加入的试剂可能是:浓硫酸(1分),作用是干燥氢气(2分)。
③应观察到C中的实验现象是:固体由黑色变成红色(2分),D中最好选择的试剂是:固体无水硫酸铜(1分)。
(3)改进时可选用的下列仪器为 a、c、e、g (填代号)。(2分)
略

练习册系列答案
相关题目

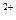 、Ag
、Ag ,同时又测得其酸性很强。某学生还要鉴定此溶液中是否大量存在:①Cu
,同时又测得其酸性很强。某学生还要鉴定此溶液中是否大量存在:①Cu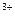 、③ Cl
、③ Cl 、④ NO
、④ NO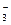 、⑤ S
、⑤ S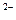 、⑥ CO
、⑥ CO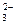 、⑦ NH
、⑦ NH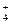 、⑧ Mg
、⑧ Mg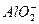 离子。其实,这些离子中有一部分不再鉴定就能加以否定,你认为不必鉴定的离子组是( )
离子。其实,这些离子中有一部分不再鉴定就能加以否定,你认为不必鉴定的离子组是( )