题目内容
【题目】有一无色透明溶液,可能含Al3+、Fe3+、Cu2+、Mg2+、K+、OH-、CO32-、Cl-离子中的若干种。现做如下实验:
(1)取少量该溶液,滴入用硝酸酸化的AgNO3溶液,有白色沉淀生成。
(2)另取部分溶液,加入氢氧化钠,有白色沉淀产生,加入氢氧化钠的量与生成白色沉淀的量可用下图表示。
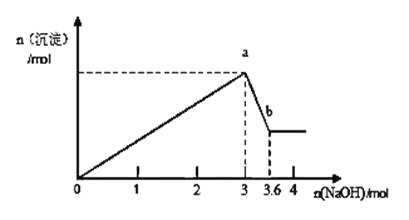
试推断:
①该溶液中以上离子一定存在的有__________,一定不存在的有__________。
②上述溶液中至少由___________、__________(填化学式)等溶质混合而成,其物质的量比为__________。
③写出图中a→b变化过程的离子方程式_____________________。
④为进一步确定溶液中其他的阳离子,应该补充的实验操作和结论是________。
【答案】(1)Al3+、Mg2+、Cl-;Fe3+、Cu2+、OH-、CO32-;
(2)AlCl3、MgCl2;1∶1
(3)Al(OH)3+OH-=AlO2-+2H2O
(4)用洁净铂丝蘸取少量溶液,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察,火焰呈紫色则溶液中含K+,若没有观察到火焰呈紫色则溶液中不含K+。
【解析】
试题分析:该溶液为无色透明溶液,则溶液中不含Fe3+、Cu2+,向溶液中加入硝酸酸化的硝酸银溶液产生白色沉淀,则溶液中存在Cl-;向溶液中加入氢氧化钠溶液,根据图象知,先随着加入氢氧化钠量的增多,沉淀的量增大,当达到一定程度后,再加入氢氧化钠,沉淀的量减少,但最终还有白色沉淀,说明溶液还含有Al3+、Mg2+,则溶液中不含CO32-、OH-;
(1)根据以上分析可知,溶液中一定存在Cl-、Al3+、Mg2+,不存在的离子为Fe3+、Cu2+、OH-、CO32-;故答案为:Cl-、Al3+、Mg2+;Fe3+、Cu2+、OH-、CO32-;
(2)根据(1)分析知,溶液中含有Cl-、Al3+、Mg2+,所以溶液中最少含有两种物质:MgCl2、AlCl3,根据OH-+Al(OH)3=AlO2-+2H2O知,n(Al(OH)3)=(3.6-3)mol=0.6mol,根据原子守恒知,n(AlCl3)=n(Al(OH)3)=0.6mol,根据3OH-+Al3+=Al(OH)3↓知,生成氢氧化铝需要n(NaOH)=1.8mol,则生成氢氧化镁需要的n(MaOH)=(3-1.8)mol=1.2mol,根据2OH-+Mg2+=Mg(OH)2↓知,n(Mg2+)=0.6mol,根据原子守恒知,n(MgCl2)=0.6mol,所以n(AlCl3):n(Mg2+)=0.6mol:0.6mol=1:1,故答案为:MgCl2;AlCl3;1:1;
(3)沉淀溶解过程中发生的反应为:氢氧化铝和氢氧根离子生成偏铝酸根离子和水的反应,离子反应方程式为:OH-+Al(OH)3=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)溶液中的钾离子无法确定,钾元素的焰色反应为紫色,所以可以通过焰色反应判断是否存在,其操作为:用洁净铂丝蘸取少量溶液,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察,火焰呈紫色,则溶液中含K+,若没有观察到火焰呈紫色,则溶液中不含K+;故答案为:用洁净铂丝蘸取少量溶液,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察,火焰呈紫色,则溶液中含K+,若没有观察到火焰呈紫色,则溶液中不含K+。

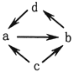
【题目】下列各组物质之间通过一步就能实现如图所示转化的是( )
物质编号 | 物质转化关系 | a | b | c | d |
① |
| Na2O | Na2O2 | Na | NaOH |
② | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
③ | FeCl2 | FeCl3 | Fe | CuCl2 | |
④ | NO | NO2 | N2 | HNO3 |
A.①② B.②③. C.②④ D.①③