题目内容
(2008?淮南一模)甲图是元素周期表的框架
(1)请在上面元素周期表中画出金属元素与非金属元素的分界线.
(2)依据元素周期表回答下列问题:
A.周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是
B.周期中表的元素④和元素⑦的氢化物的熔、沸点高低顺序是
C.①-⑦元素的某单质在常温下化学性质稳定,通常可以做保护气的是
D.在上面元素周期表中全部是金属元素的主族是
a.IA族 b.ⅡA族 c.ⅣA族 d.VIIA族
(3)已知甲元素位于第三周期,且其原子半径为同周期金属元素中的原子最小的,请写出甲的氧化物与NaOH溶液反应的离子方程式
①、③两种元素的单质已被应用于宇宙飞船的燃料电池中,如图乙所示,两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出并在电极表面放电.请回答:
b是电池的
(1)请在上面元素周期表中画出金属元素与非金属元素的分界线.
(2)依据元素周期表回答下列问题:
A.周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是
NaOH>Mg(OH)2
NaOH>Mg(OH)2
(用化学式表示).B.周期中表的元素④和元素⑦的氢化物的熔、沸点高低顺序是
HF>HCl
HF>HCl
(用化学式表示).C.①-⑦元素的某单质在常温下化学性质稳定,通常可以做保护气的是
N2
N2
(用化学式表示).D.在上面元素周期表中全部是金属元素的主族是
b
b
;全部是非金属元素的主族是d
d
(填写a、b、c、d).a.IA族 b.ⅡA族 c.ⅣA族 d.VIIA族
(3)已知甲元素位于第三周期,且其原子半径为同周期金属元素中的原子最小的,请写出甲的氧化物与NaOH溶液反应的离子方程式
Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
;在一定条件下1g①的单质在足量③的单质中完全燃烧生成液态物质时,放出的热量为akJ,请写出此条件下表示①的单质燃烧热的热化学方程式H2(g)+
O2(g)=H2O(l)△H=-2akJ/mol
| 1 |
| 2 |
H2(g)+
O2(g)=H2O(l)△H=-2akJ/mol
;| 1 |
| 2 |
①、③两种元素的单质已被应用于宇宙飞船的燃料电池中,如图乙所示,两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出并在电极表面放电.请回答:
b是电池的
正
正
极; a电极上的电极反应式是2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O
2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O
.
分析:(1)在p区金属元素与非金属元素之间画出金属元素与非金属元素的分界线;
(2)A.⑤为Na,⑥为Mg,金属性越强,对应最高价氧化物的水化物碱性越强;
B.④为F,⑦为Cl,HF中含氢键,沸点高;
C.①-⑦元素的单质中,②的单质为氮气,性质稳定;
D.⑤⑥为主族金属元素,①②③④⑦为主族非金属元素;
(3)甲元素位于第三周期,且其原子半径为同周期金属元素中的原子半径最小的,甲为Al,氧化铝与NaOH反应生成偏铝酸钠和水;
在一定条件下1g①的单质在足量③的单质中完全燃烧生成液态物质时,放出的热量为akJ,则1molH2燃烧放出2akJ热量,以此书写热化学方程式;反应中H元素的化合价升高,则图中a为负极,b为正极,正极上氧气得到电子,以此来解答.
(2)A.⑤为Na,⑥为Mg,金属性越强,对应最高价氧化物的水化物碱性越强;
B.④为F,⑦为Cl,HF中含氢键,沸点高;
C.①-⑦元素的单质中,②的单质为氮气,性质稳定;
D.⑤⑥为主族金属元素,①②③④⑦为主族非金属元素;
(3)甲元素位于第三周期,且其原子半径为同周期金属元素中的原子半径最小的,甲为Al,氧化铝与NaOH反应生成偏铝酸钠和水;
在一定条件下1g①的单质在足量③的单质中完全燃烧生成液态物质时,放出的热量为akJ,则1molH2燃烧放出2akJ热量,以此书写热化学方程式;反应中H元素的化合价升高,则图中a为负极,b为正极,正极上氧气得到电子,以此来解答.
解答:解:(1)在p区金属元素与非金属元素之间可画出金属元素与非金属元素的分界线,如图
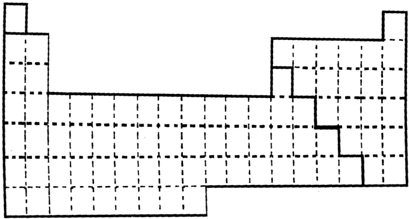 ,故答案为:
,故答案为: ;
;
(2)A.⑤为Na,⑥为Mg,金属性越强,对应最高价氧化物的水化物碱性越强,碱性为NaOH>Mg(OH)2,故答案为:NaOH>Mg(OH)2;
B.④为F,⑦为Cl,HF中含氢键,沸点高,沸点为HF>HCl,故答案为:HF>HCl;
C.①-⑦元素的单质中,②的单质为氮气,性质稳定,通常可以做保护气,其化学式为N2,故答案为:N2;
D.⑤⑥为主族金属元素,①②③④⑦为主族非金属元素,但在上面元素周期表中全部是金属元素的主族是ⅡA,故选d,而全部是非金属元素的主族是ⅤⅡA,故选b,
故答案为:b;d;
(3)甲元素位于第三周期,且其原子半径为同周期金属元素中的原子半径最小的,甲为Al,氧化铝与NaOH反应生成偏铝酸钠和水,离子反应为Al2O3+2OH-=2AlO2-+H2O;
在一定条件下1g①的单质在足量③的单质中完全燃烧生成液态物质时,放出的热量为akJ,则1molH2燃烧放出2akJ热量,则表示①的单质燃烧热的热化学方程式为H2(g)+
O2(g)=H2O (l)△H=-2akJ/mol;反应中H元素的化合价升高,则图中a为负极,负极氢气失去电子,b为正极,正极上氧气得到电子,a上的电极反应为2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;H2(g)+
O2(g)=H2O (l)△H=-2akJ/mol;正;2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O.
 ,故答案为:
,故答案为: ;
;(2)A.⑤为Na,⑥为Mg,金属性越强,对应最高价氧化物的水化物碱性越强,碱性为NaOH>Mg(OH)2,故答案为:NaOH>Mg(OH)2;
B.④为F,⑦为Cl,HF中含氢键,沸点高,沸点为HF>HCl,故答案为:HF>HCl;
C.①-⑦元素的单质中,②的单质为氮气,性质稳定,通常可以做保护气,其化学式为N2,故答案为:N2;
D.⑤⑥为主族金属元素,①②③④⑦为主族非金属元素,但在上面元素周期表中全部是金属元素的主族是ⅡA,故选d,而全部是非金属元素的主族是ⅤⅡA,故选b,
故答案为:b;d;
(3)甲元素位于第三周期,且其原子半径为同周期金属元素中的原子半径最小的,甲为Al,氧化铝与NaOH反应生成偏铝酸钠和水,离子反应为Al2O3+2OH-=2AlO2-+H2O;
在一定条件下1g①的单质在足量③的单质中完全燃烧生成液态物质时,放出的热量为akJ,则1molH2燃烧放出2akJ热量,则表示①的单质燃烧热的热化学方程式为H2(g)+
| 1 |
| 2 |
故答案为:Al2O3+2OH-=2AlO2-+H2O;H2(g)+
| 1 |
| 2 |
点评:本题考查位置、结构、性质的关系,把握元素周期表和元素周期律、元素在周期表中的位置、性质即可解答,涉及知识点较多,综合性较强,题目难度中等,注重基础知识的考查,注意规律性知识的总结和应用.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目