题目内容
向10mLNa2CO3和Na2SO4的混合溶液中加入足量的氯化钡溶液,生成沉淀的质量为6.27g,向所得沉淀中加入足量稀盐酸,沉淀质量减少到2.33g,并放出气体,试计算:
(1)原混合物中Na2SO4的物质的量浓度;
(2)在标准状况下产生气体的体积。
(1)设Na2SO4的物质的量为x
BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl
1mol 233g
x 2.33g ∴ x = 0.01mol
∴ 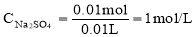 (3分)
(3分)
(2)设产生的气体的体积为V
BaCO3 ~ CO2↑
197g 22.4L
6.27g – 2.33g =3.94g V ∴ V = 0.448L(3分)
【解析】
试题分析:根据题意知,向Na2CO3和Na2SO4的混合溶液中加入足量的氯化钡溶液,发生的反应为BaCl2+Na2SO4=BaSO4↓+2NaCl ,BaCl2+Na2CO3=BaCO3↓+2NaCl,生成的沉淀为硫酸钡和碳酸钡的混合物,质量为6.27g,向所得沉淀中加入足量稀盐酸,发生的反应为BaCO3+2HCl=BaCl2+H2O+CO2↑,剩余沉淀为硫酸钡,质量为2.33g,则碳酸钡的质量6.27g – 2.33g =3.94g;(1)由上述分析结合守恒思想知n(Na2SO4) =n(BaSO4)=0.01mol,根据公式c=n/v计算,原混合物中Na2SO4的物质的量浓度为1mol/L;
(2)设产生的气体的体积为V
BaCO3 ~ CO2↑
197g 22.4L
3.94g V
解得 V = 0.448L。
考点:考查有关化学方程式的计算。

练习册系列答案
相关题目