题目内容
(2010?聊城模拟)海洋中资源丰富,以海水为原料可制得一系列产品,如图所示: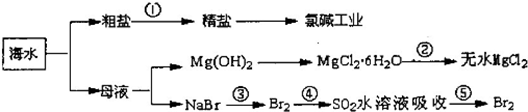
下列有关说法正确的是( )

下列有关说法正确的是( )
分析:A、把杂质转化为沉淀或气体除去,除钙离子用碳酸根,除镁离子用氢氧根,除Fe3+用氢氧根,除硫酸根用钡离子.要注意除杂质的顺序,后加的试剂最好能把前面先加是过量试剂除掉;
B、MgCl?6H2O在空气中加热分解得到氯化镁和水,氯化镁易水解;
C、③是溴元素被氧化,④是溴单质被还原,⑤是溴元素被氧化;
D、电解饱和食盐水溶液中阳离子H+移向阴极,阴离子Cl-移向阳极,
B、MgCl?6H2O在空气中加热分解得到氯化镁和水,氯化镁易水解;
C、③是溴元素被氧化,④是溴单质被还原,⑤是溴元素被氧化;
D、电解饱和食盐水溶液中阳离子H+移向阴极,阴离子Cl-移向阳极,
解答:解:A、除去粗盐中的可溶性杂质:Mg2+、Ca2+、Fe3+、SO42-时,可以加入过量NaOH(去除镁离子和铁离子):Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓;
加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3,碳酸钠必须加在氯化钡之后,氢氧化钠和氯化钡可以颠倒加入的顺序;故A错误;
B、结晶出的MgCl?6H2O在空气中加热分解得到氯化镁和水,氯化镁水解得不到无水MgCl2,应在氯化氢气流中脱水,防止镁离子水解,故B错误;
C、③是溴元素被氧化为溴单质,④是溴单质被还原为溴离子,⑤是溴元素被氧化为溴单质;此过程是富集溴的操作,故C错误;
D、电解饱和食盐水溶液中阴离子Cl-移向阳极,阳离子H+移向阴极得到电子发生还原反应生成氢气,电极附近氢氧根离子浓度增大,形成氢氧化钠,故D正确;
故选D.
加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3,碳酸钠必须加在氯化钡之后,氢氧化钠和氯化钡可以颠倒加入的顺序;故A错误;
B、结晶出的MgCl?6H2O在空气中加热分解得到氯化镁和水,氯化镁水解得不到无水MgCl2,应在氯化氢气流中脱水,防止镁离子水解,故B错误;
C、③是溴元素被氧化为溴单质,④是溴单质被还原为溴离子,⑤是溴元素被氧化为溴单质;此过程是富集溴的操作,故C错误;
D、电解饱和食盐水溶液中阴离子Cl-移向阳极,阳离子H+移向阴极得到电子发生还原反应生成氢气,电极附近氢氧根离子浓度增大,形成氢氧化钠,故D正确;
故选D.
点评:本题考查了海水提取溴的工艺流程,氯碱工业的反应原理,掌握基础是解题关键,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目