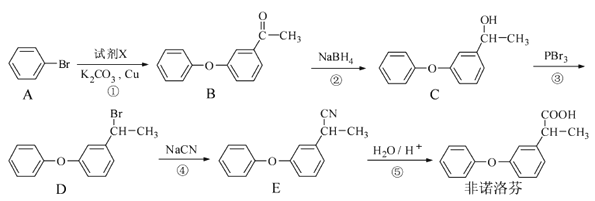
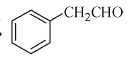
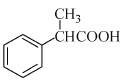
题目内容
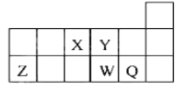
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图。下列说法正确的是()
A. 元素Y与元素Z的最高正化合价之和的数值等于9
B. 离子Y2-和Z3+的核外电子数和电子层数都不相同
C. 原子半径的大小顺序为:rZ> rW>rQ>rX>rY
D. 元素W的氢化物稳定性和还原性均比Q的强
【答案】C
【解析】
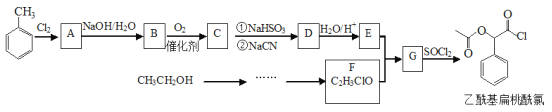
X、Y、Z、W、Q都是短周期元素,根据元素在周期表中的位置可以知道,X是N元素、Y是O元素、Z是Al元素、W是S元素、Q是Cl元素,以此分析解答。
A.Y为氧元素,没有最高正化合价,故A错误;
B.O2-和Al3+离子核外电子数都是10,电子层结构相同,故B错误;
C.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:rZ>rW>rQ>rX>rY,所以C选项是正确的;
D.非金属性Cl>S,氢化物稳定性:HCl>H2S,还原性:HCl<H2S,故D错误。
所以C选项是正确的。

 名校课堂系列答案
名校课堂系列答案【题目】氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。某实验小组以H2O2分解为例,探究浓度、催化剂、温度对反应速率的影响。在常温下按照下表所示的方案完成实验。
实验编号 | 温度(℃) | 反应物 | 催化剂 |
① | 20 | 25 mL 3% H2O2溶液 | 无 |
② | 20 | 25 mL 5% H2O2溶液 | 无 |
③ | 20 | 25 mL 5% H2O2溶液 | 0.1g MnO2 |
④ | 20 | 25 mL 5% H2O2溶液 | 1~2滴1mol/L FeCl3溶液 |
⑤ | 30 | 25 mL 5% H2O2溶液 | 0.1g MnO2 |
(1)实验①和②的目的是____________________________。同学甲在进行实验时并没有观察到明显现象。资料显示,通常条件下过氧化氢稳定,不易分解。为了达到实验目的,可采取的改进方法是__________(写出一种即可)。
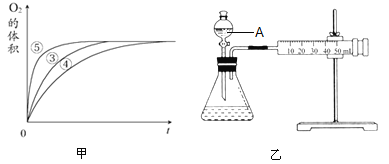
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如甲图所示。分析该图能得出的结论是__________________________,__________________________;
(3)写出实验③中H2O2分解的化学方程式:______________________________;
(4)同学乙设计了乙图所示的实验装置对过氧化氢的分解速率进行定量分析。以生成10mL气体为准,其他影响实验的因素均已忽略。图中仪器A的名称为__________,实验中需要测量的数据是______________。
(5)某反应在体积为2L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如图所示(已知X、Y、Z均为气体).
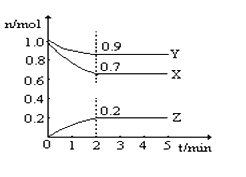
①该反应的化学方程式为______.
②反应开始至2分钟时,Y的平均反应速率为______.
③能说明该反应已达到平衡状态的是______
A.υ(X)=3υ(Y)B.容器内气体密度不变
C.υ逆(Z)=2υ正(Y)D.各组分的物质的量相等
E.混合气体的平均相对分子质量不再改变的状态
④由图求得平衡时X的转化率为______.