��Ŀ����
����Ŀ��A��B��C�Ƕ����ڷǽ���Ԫ�أ��˵������������AԪ��ԭ�Ӻ��������ֲ�ͬ���ܼ��Ҹ����ܼ������ĵ�������ͬ��C�ǵؿ��к�������Ԫ�أ�D��E�ǵ�������Ԫ�أ�����EԪ�صĺ˵����Ϊ29��Dԭ�Ӻ���δ�ɶԵ�������ͬ��������࣮���ö�Ӧ��Ԫ�ط��Ż�ѧʽ��գ�
��1��A��B��C�ĵ�һ��������С�����˳��Ϊ ��
��2��B���⻯����Һ����ԭ������
��3����֪A��C�γɵĻ�������Ӽ��������ЧӦ��l mol���к��Цм�����ĿΪ��
��4����̬Dԭ�ӵ���Χ�����Ų�ʽΪ �� DO2Cl2�۵㣺��96.5�棬�е㣺117�棬���̬DO2Cl2�������壮
��5��E���⻯��ľ����ṹ��ͼ��ʾ���仯ѧʽ�� �� 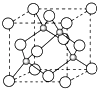
���𰸡�
��1��C��O��N
��2��NH3���Ӽ����γ�������е��
��3��1.204��1024����2NA
��4��3d54s1������
��5��CuH
���������⣺A��B��C�Ƕ����ڷǽ���Ԫ�أ��˵������������AԪ��ԭ�Ӻ��������ֲ�ͬ���ܼ��Ҹ����ܼ������ĵ�������ͬ����A��CԪ�أ�C�ǵؿ��к�������Ԫ�أ���C��OԪ�أ�Bԭ����������A��С��C������B��NԪ�أ� D��E�ǵ�������Ԫ�أ�����EԪ�صĺ˵����Ϊ29����E��Cu��Dԭ�Ӻ���δ�ɶԵ�������ͬ��������࣬��D��CrԪ�أ���1��ͬһ����Ԫ�أ�Ԫ�ص�һ����������ԭ��������������������ƣ�����IIA�塢��VA��Ԫ�ص�һ�����ܴ���������Ԫ�أ����Ե�һ������C��O��N���ʴ�Ϊ��C��O��N����2��B���⻯���ǰ���������������⻯���۷е�ϸߣ������к�������������۷е�ϸߣ�������Һ�����ʴ�Ϊ��NH3���Ӽ����γ�������е�ߣ���3��A��C�γɵĻ�������Ӽ��������ЧӦ����Ϊ������̼��ÿ��O=C=O�����к���2���м�����1mol������̼�����Цм�����Ϊ1.204��1024����2NA �� �ʴ�Ϊ��1.204��1024����2NA����4��D��CrԪ�أ���3d��4s�ܼ�����Ϊ����Χ���ӣ����ݹ���ԭ����д����Χ�����Ų�ʽΪ3d54s1�����Ӿ����۷е�ϵͣ��������۷е�ϵͣ�����Ϊ���Ӿ��壬�ʴ�Ϊ��3d54s1�����ӣ���5������ԭ�Ӱ뾶��С֪��С���ʾHԭ�ӡ������ʾCuԭ�ӣ�Hԭ�Ӹ���=4��Cuԭ�Ӹ���=8�� ![]() +6��
+6�� ![]() =4������H��Cuԭ�Ӹ���=4��4=1��1�������仯ѧʽΪCuH���ʴ�Ϊ��CuH�� A��B��C�Ƕ����ڷǽ���Ԫ�أ��˵������������AԪ��ԭ�Ӻ��������ֲ�ͬ���ܼ��Ҹ����ܼ������ĵ�������ͬ����A��CԪ�أ�C�ǵؿ��к�������Ԫ�أ���C��OԪ�أ�Bԭ����������A��С��C������B��NԪ�أ�
=4������H��Cuԭ�Ӹ���=4��4=1��1�������仯ѧʽΪCuH���ʴ�Ϊ��CuH�� A��B��C�Ƕ����ڷǽ���Ԫ�أ��˵������������AԪ��ԭ�Ӻ��������ֲ�ͬ���ܼ��Ҹ����ܼ������ĵ�������ͬ����A��CԪ�أ�C�ǵؿ��к�������Ԫ�أ���C��OԪ�أ�Bԭ����������A��С��C������B��NԪ�أ�
D��E�ǵ�������Ԫ�أ�����EԪ�صĺ˵����Ϊ29����E��Cu��Dԭ�Ӻ���δ�ɶԵ�������ͬ��������࣬��D��CrԪ�أ���1��ͬһ����Ԫ�أ�Ԫ�ص�һ����������ԭ��������������������ƣ�����IIA�塢��VA��Ԫ�ص�һ�����ܴ���������Ԫ�أ���2������������⻯���۷е�ϸߣ���3��A��C�γɵĻ�������Ӽ��������ЧӦ����Ϊ������̼��ÿ��O=C=O�����к���2���м�����4��D��CrԪ�أ���3d��4s�ܼ�����Ϊ����Χ���ӣ����ݹ���ԭ����д����Χ�����Ų�ʽ�����Ӿ����۷е�ϵͣ���5�����þ�̯��ȷ���þ�����ѧʽ��
