题目内容
14.下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(2)请写出⑨的原子结构示意图:
 .
.(3)④、⑤、⑧元素非金属性由强到弱的顺序是F>O>S(用元素符号表示).
(4)⑥与⑦两种元素金属性强弱顺序为:⑥>⑦(填“>”或“<”或“=”)
(5)请写出⑧元素最高价氧化物的化学式:SO3.
分析 (1)由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为F、⑥为Na、⑦为Al、⑧为S,⑨为Cl;
(2)⑨为Cl元素,原子核内有17个质子,核外有3个电子层,各层电子数为2、8、7;
(3)③为N、④为O、⑧为S,同周期从左到右非金属性增强,同主族元素从上到下非金属性减弱;
(4)同周期自左而右,元素金属性减弱;
(5)⑧为S元素,硫的最高价氧化物为三氧化硫,化学式为:SO3.
解答 解:(1)由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为F、⑥为Na、⑦为Al、⑧为S,⑨为Cl,⑦为Al元素,元素名称为铝,
故答案为:铝;
(2)在原子结构示意图中,圆圈表示原子核,圆圈内的数值为质子数,核外电子层用弧线表示,弧线上的数据表示每层的电子数,氯原子示意图为: ;
;
故答案为: ;
;
(3)同周期从左到右非金属性增强,则O<F,同主族元素从上到下非金属性减弱:O>S,所以非金属性由强到弱的顺序是:F>O>S,
故答案为:F>O>S;
(4)同周期自左而右,元素金属性减弱,故金属性Na>Al,
故答案为:>;
(5)⑧为S元素,硫为16号元素,原子最外层电子数为6,最高价为+6价,其氧化物为三氧化硫,化学式为:SO3,
故答案为:SO3.
点评 本题考查元素的推断,根据元素在周期表中的物质可推断出元素的种类,题中侧重于周期律的应用,学习中注意积累相关知识,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.标准状况下将 aL HCl气体溶于bmL水中,得到的盐酸溶液密度为c g•cm-3,则该溶液中溶质的物质的量的浓度可表示为( )
| A. | $\frac{ac}{22400}$mol•L-1 | B. | $\frac{a}{22.4b}$mol•L-1 | ||
| C. | $\frac{ac}{22400b+36.5}$mol•L-1 | D. | $\frac{1000ac}{22.4b+36.5a}$mol•L-1 |
2.在温度不变,恒容的容器中进行反应CO(g)+H2O(g)?H2(g)+CO2(g)△H>0,若反应物的浓度由0.1mol•L-1降到0.06mol•L-1需20s,那么由0.06mol•L-1降到0.036mol•L-1所需反应时间应为( )
| A. | 10 s | B. | 12 s | C. | 大于12 s | D. | 小于12 s |
9.下列溶液一定呈中性的是( )
| A. | 加甲基橙呈黄色的溶液 | B. | pH=7 的溶液 | ||
| C. | c(H+)=10-14mol/L的溶液 | D. | c(OH-)=$\sqrt{Kw}$ 的溶液 |
6.体育锻炼后,会感到肌肉酸痛,其主要原因是体内的糖、脂肪、蛋白质被大量分解,产生乳酸、磷酸等酸性食物.下列哪些食物可以消除体内过多的酸性食物( )
①豆制品;②肉;③蔬菜;④蛋;⑤水果;⑥鱼.
①豆制品;②肉;③蔬菜;④蛋;⑤水果;⑥鱼.
| A. | ①③④ | B. | ②④⑥ | C. | ①③⑤ | D. | ③⑤⑥ |
3.下列说法中正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 任何放热反应在常温条件下一定能够发生 | |
| C. | 总能量大于生成物总能量的反应是吸热反应 | |
| D. | 反应物和生成物所具有的总能量的差决定了化学反应是放热还是吸热反应物 |
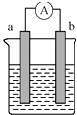 如图是某化学兴趣小组探究不同条件下化学能转化为电能的装置.请回答下列问题.
如图是某化学兴趣小组探究不同条件下化学能转化为电能的装置.请回答下列问题.