题目内容
4.向铜片中加入某浓度的硫酸120mL,在加热条件下反应,待铜片全部溶解后,将溶液稀释到500mL,再加入足量的锌粉,使之完全反应收集到标况下2.24L,过滤后得固体,干燥后质量减轻了0.75g,求原浓硫酸的物质的量浓度.分析 发生Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,再加入足量的锌粉,发生Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑,结合n=$\frac{V}{Vm}$、c=$\frac{n}{V}$计算.
解答 解:再加入足量的锌粉,发生Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑,
由n(H2)=$\frac{2.24L}{22.4L/mol}$=0.1mol、Zn+H2SO4=ZnSO4+H2↑可知,剩余硫酸为0.1mol,
又过滤后得固体,干燥后质量减轻了0.75g,则
Zn+CuSO4=ZnSO4+Cu 质量差
65 64 1
m 0.75g
解得m(Cu)=48g,n(Cu)=$\frac{48g}{64g/mol}$=0.75mol,
由Cu原子守恒及Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O可知,消耗的硫酸为0.75mol×2=1.5mol,
原硫酸的物质的量为1.5mol+0.1mol=1.6mol,其浓度为$\frac{1.6mol}{0.12L}$=13.33mol/L,
答:原浓硫酸的物质的量浓度为13.33mol/L.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应、质量差计算及物质的量的有关计算为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.分子式为C7H8,且分子中含有苯环的烃的一氯代物有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 7种 |
15.城市生活垃圾需实行分类投放,其中废塑料、废橡胶制品都属于( )
| A. | 无机物 | B. | 有机物 | C. | 盐类 | D. | 糖类 |
12.下列实验操作或对实验事实的叙述正确的是( )
| A. | 用瓷坩埚高温熔融NaOH | |
| B. | 用氨气做喷泉实验主要是利用氨气的水溶液呈碱性这一性质 | |
| C. | 碳酸钠的溶解性比碳酸氢钠大 | |
| D. | 检验Fe2+用KSCN溶液 |
19.下列实验操作中有错误的是( )
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从下口放出 | |
| B. | 实验室制取蒸馏水的装置中,温度计水银球应与蒸馏烧瓶的支管口在同一水平线 | |
| C. | 用淘洗的方法从沙里淘金 | |
| D. | 用蒸发方法使NaCl从溶液中析出时,应边加热边搅拌直至溶液蒸干 |
13.下表中对离子方程式的评价不合理的是
( )
| 选项 | 化学反应及离子方程式 | 评价 |
| A | NaClO溶液中通往少量的SO2: ClO-+H2O+SO2=Cl-+SO42-+2H+ | 错误,碱性介质中不可能生成H+ |
| B | 用酸性高锰酸钾溶液滴定草酸: 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O | 正确 |
| C | NH4Al(SO4)2溶液中滴入少量NaOH溶液 NH4++OH-=NH3•H2O | 错误,OH-首先和Al3+反应生成Al(OH)3沉淀 |
| D | 用惰性电极电解CuCl2溶液 2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | 正确 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
14.对丁烷进行裂解,不能得到的物质是( )
| A. | 乙烷 | B. | 丙烷 | C. | 甲烷 | D. | 丙烯 |
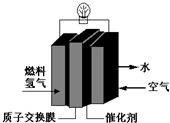 第29届奥运会期间,作为马拉松领跑车和电视拍摄车的汽车,装着“绿色心脏”--质子交换膜燃料电池,其工作原理如图所示.
第29届奥运会期间,作为马拉松领跑车和电视拍摄车的汽车,装着“绿色心脏”--质子交换膜燃料电池,其工作原理如图所示.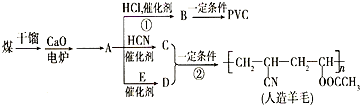 近年来,由于石油价格不断上涨,以煤为原料制备一些化工产品的前景又被看好.如图是以煤为原料生产(PVC)和人造羊毛的合成路线.
近年来,由于石油价格不断上涨,以煤为原料制备一些化工产品的前景又被看好.如图是以煤为原料生产(PVC)和人造羊毛的合成路线.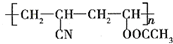 .
.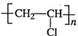 .
.