题目内容
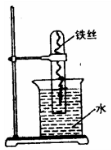
有人将铂丝插入KOH溶液中做电极,又在两极片上分别通入甲烷和氧气,设计一种燃料电池,则通入甲烷的铂丝为______极,发生的电极反应为______.该电池放电反应的化学方程式为______.电池工作时,溶液的pH(填“变小”“不变”“变大”)______.
负 CH4+10OH--8e-=CO32-+7H2O CH4+2O2+2KOH=K2CO3+3H2O 变小
因为该电池为燃料电池,依据的化学原理是
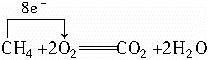 ?
?
在此反应中,CH4失去电子,因此通入CH4的铂丝为负极。CH4在负极失电子转变成CO2,但因在碱性条件下CO2将转化成CO32-,所以负极反应为:
CH4+10OH--8e-= CO32-+7H2O
正极反应为:2O2+8e-+4H2O=8OH-
该电池放电反应的化学方程式为:
CH4+2O2+2KOH=K2CO3+3H2O
由此可知反应过程中c(OH-)不断减小,c(H+)则不断增大,pH将变小。
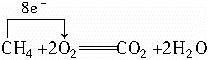 ?
?在此反应中,CH4失去电子,因此通入CH4的铂丝为负极。CH4在负极失电子转变成CO2,但因在碱性条件下CO2将转化成CO32-,所以负极反应为:
CH4+10OH--8e-= CO32-+7H2O
正极反应为:2O2+8e-+4H2O=8OH-
该电池放电反应的化学方程式为:
CH4+2O2+2KOH=K2CO3+3H2O
由此可知反应过程中c(OH-)不断减小,c(H+)则不断增大,pH将变小。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目