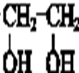题目内容
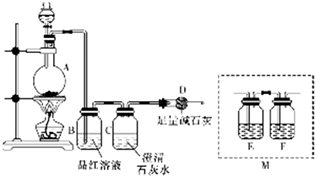
9.下列实验方法或操作不正确的是( )| A. | 蒸馏实验中,为了防止暴沸,要在蒸馏烧瓶中加入沸石 | |
| B. | 可用丁达尔效应区别溶液和胶体 | |
| C. | 用CCl4萃取碘水后分液时,先打开分液漏斗活塞,放出下层液体,再关闭活塞,从漏斗上口倒出上层液体 | |
| D. | 检验某溶液中是否含有Fe2+时,可先加入适量的氯水,再滴加硫氰化钾溶液,若溶液变为红色,则说明溶液中一定含有Fe2+ |
分析 A.加入碎瓷片可防止液体暴沸;
B.胶体具有丁达尔效应,而溶液不具有此性质;
C.分液时,上层液体从分液漏斗上口倒出,下层液体从分液漏斗下口放出;
D.检验亚铁离子时,应该先加入硫氰化钾溶液,排除铁离子干扰,然后再加入氯水,否则无法证明原溶液中是否存在铁离子.
解答 解:A.蒸馏时,加入碎瓷片可防止液体暴沸,故A正确;
B.由于胶体具有丁达尔效应,而溶液不具有该性质,所以可用丁达尔效应区别溶液和胶体,故B正确;
C.用CCl4萃取碘水后分液时,为了避免试剂污染,应该先打开分液漏斗活塞,放出下层液体,再关闭活塞,从漏斗上口倒出上层液体,故C正确;
D.检验某溶液中是否含有Fe2+时,先加入适量的氯水,再滴加硫氰化钾溶液,即使溶液变为红色,由于没有排除铁离子干扰,原溶液中可能含有铁离子,不一定含有Fe2+,故D错误.
故选D.
点评 本题考查化学实验方案的评价,涉及亚铁离子与铁离子的检验方法、物质的鉴别、分离与提纯,题目难度中等,注意掌握检验亚铁离子和铁离子的方法,明确物质鉴别方法及常见的物质分离与提纯操作方法.

练习册系列答案
相关题目
1.常温下,四个容积为20L的容积中分别装有质量相同的下列气体,产生的压强最大的是( )
| A. | Cl2 | B. | HCl | C. | SO2 | D. | CO2 |
14.己知X、Y、Z、W、N、U、V是短周期的主族元素,原子序数依次增大.X与N同主族,且与W都能形成A2B、A2B2型化合物;Z、W的单质常温下均为无色气体;Y原子的L层电子数是K层电子数的2倍;U原子的最外层电子数是其电子层数的2倍.下列说法不正确的是( )
| A. | N的单质的晶体属于金属晶体;U的氢化物的球棍模型示意图为 | |
| B. | 工业上V的单质的制备可以电解熔融的NV | |
| C. | Z的最高价氧化物对应的水化物能与其气态氢化物反应生成盐 | |
| D. | X、Y、Z、W四种元素(按顺序)可组成原子个数比为5:1:1:3的化合物;也可形成结构式为X-W-Y≡Z的化合物 |
1.下列离子方程式书写正确的是( )
| A. | 向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | NH4HSO3溶液与足量NaOH溶液反应:HSO3-+OH-═SO32-+H2O | |
| C. | Fe(OH)2溶于稀HNO3:Fe(OH)2+2H+═Fe2++2H2O | |
| D. | H218O2中加入H2SO4酸化的KMnO4 5H218O2+2MnO4-+6H+═518O2+2Mn2++8H2O |
18.下列化学用语表达错误的是( )
| A. | NH3的电子式: | |
| B. | 氯离子的结构示意图: | |
| C. | CS2的结构式:S=C=S | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O |

 结构相似的有机物不稳定,发生分子重排生成
结构相似的有机物不稳定,发生分子重排生成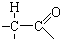
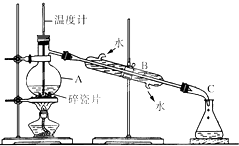
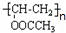 .
.
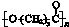 .其合成路线如下.
.其合成路线如下.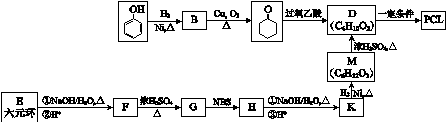
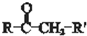 $\stackrel{过氧乙酸}{→}$
$\stackrel{过氧乙酸}{→}$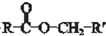 ②R-CH=CH-CH3$\stackrel{NBS}{→}$R-CH=CH-CH3Br
②R-CH=CH-CH3$\stackrel{NBS}{→}$R-CH=CH-CH3Br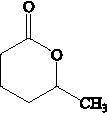 .
. .
.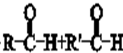
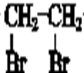 $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$