题目内容
(07年广东卷)(11分)已知某混合金属粉末,除铝处还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合物金属粉末中铁、铜元素的存在。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol/L硫酸、2mol/L硝酸、2mol/LNaOH溶液、20%KSCN溶液。
完成以下实验探究过程:
(1)提出假设:
假设1:该混合金属粉末中除铝外还含有 元素;
假设2:该混合金属粉末中除铝外还含有 元素;
假设3:该混合金属粉末中除铝外还含有Fe、Cu元素;
(2)设计实验方案
基于假设3,设计出实验方案(不要在答题卡上作答)。
(3)实验过程
根据(2)的实验方案,叙述实验操作、预期现象和结论。
【提示】Ⅰ.在答题卡上按以下方式作答,注意前后内容对应;
Ⅱ.注意文字简洁,确保不超过答题卡空间。

答案:(1)Cu;Fe(顺序可交换)
(3)
编号 | 实验操作 | 预期现象和结论 |
① | 用药匙取少许样品,加入试管A中,再用滴管取过量NaOH溶液并滴加到试管A中,充分反应后,静置,弃去上层清液,剩余固体备用
| 样品部分溶解,并有气体放出 |
② |
往试管A的剩余固体中加过量稀硫酸,充分反应后,静置。取上层清液于试管B中,剩余固体备用 | 固体部分溶解,并有气体放出,溶液呈浅绿色,可能含铁 |
③ | 往试管B中加入少许稀硝酸,再滴加KSCN溶液
| 溶液先变黄色,加KSCN后显血红色,结合②可知,一定含铁 |
④ |
往②剩余固体中加入稀硝酸,再滴加NaOH溶液 | 固体溶解,有无色刺激性气体产生并很快变成红棕色,溶液显蓝色,加NaOH溶液后有蓝色沉淀产生,一定含铜。 |
解析:在生产和科学研究中,常常需要对一些物质的成分进行检验,本题在设计实验时,要充分考虑到Al、Fe、Cu三种金属在性质上的差异,从而达到探究实验的目的。
① 2Al + 2NaOH +2H2O= 2NaAlO2 +3H2↑,而Fe、Cu与碱液不反应;
② Fe + H2SO4 = FeSO4 + H2↑,而Cu不与稀硫酸反应;
③ 加入稀硝酸后,溶液中的Fe2+会被硝酸氧化为Fe3+,Fe3+可用SCN-进行检验;
④ 3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑ + 4H2O, Cu2+ + 2OH- = Cu(OH)2↓(蓝色),通过分析上述反应过程的现象,完成对样品成分的确定。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案(07年广东卷)(10分)已知苯甲醛在一定条件下可以通过Perkin反应生成肉桂酸(产率45~50%),另一个产物A也呈酸性,反应方程式如下:
C6H5CHO+(CH3CO)2O → C6H5CH=CHCOOH+ A
苯甲醛 肉桂酸
(1)Perkin反应合成肉桂酸的反应式中,反应物的物质的量之比为11。产物A的名称是
(2)一定条件下,肉桂酸与乙醇反应生成香料肉桂酸乙酯,其反应方程式为________(不要求标出反应条件)
(3)取代苯甲醛也能发生Perkin反应,相应产物的产率如下:
取代苯甲醛 |
|
|
|
|
产率(%) | 15 | 23 | 33 | 0 |
取代苯甲醛 |
|
|
|
|
产率(%) | 71 | 63 | 52 | 82 |
可见,取代基对Perkin反应的影响有(写出3条即可):
①
②
③
(4)溴苯(C6H5Br)与丙烯酸乙酯(CH2=CHCOOC2H5)在氯化钯催化下可直接合成肉桂酸乙酯,该反应属于Beck反应,是芳香环上的一种取代反应,其反应方程式为_________(不要求标出反应条件)
(5)Beck反应中,为了促进反应的进行,通常可加入一种显 (填字母)的物质
A 弱酸性 B 弱碱性 C 中性 D 强酸性
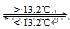 Sn(s、白) △H3= + 2.1kJ/mol
Sn(s、白) △H3= + 2.1kJ/mol




