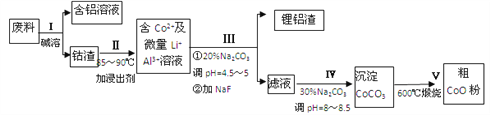
题目内容
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.1 mol·L-1(NH4)2Fe(SO4)2溶液中:c(SO![]() )=c(NH
)=c(NH![]() )>c(Fe2+)>c(H+)>c(OH-)
)>c(Fe2+)>c(H+)>c(OH-)
B.pH=2的HNO3溶液与pH=12的NH3·H2O溶液等体积混合:
c(NH![]() )+c(H+)=c(OH-)+c(NO
)+c(H+)=c(OH-)+c(NO![]() )
)
C.浓度均为0.1 mol/L的Na2CO3与NaHCO3混合溶液:
c(Na+)>c(HCO![]() )>c(CO
)>c(CO![]() )>c(OH-)
)>c(OH-)
D.0.1 mol/L NaHS溶液:c(OH-)=c(H+)+2c(H2S)+c(HS-)
【答案】BC
【解析】
试题分析:A.1L0.1molL-1(NH4)2Fe(SO4)2溶液中铵根离子浓度大于亚铁离子浓度水解显酸性得到溶液中离子浓度大小为:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-),故A错误;B.pH=2的HNO3溶液与pH=12的NH3·H2O溶液等体积混合的溶液里存在的电荷守恒式为c(NH![]() )+c(H+)=c(OH-)+c(NO
)+c(H+)=c(OH-)+c(NO![]() ),故B正确;C.浓度均为0.1 mol/L的Na2CO3与NaHCO3混合溶液,因CO32-的水解程度大于HCO3-,则c(Na+)>c(HCO
),故B正确;C.浓度均为0.1 mol/L的Na2CO3与NaHCO3混合溶液,因CO32-的水解程度大于HCO3-,则c(Na+)>c(HCO![]() )>c(CO
)>c(CO![]() )>c(OH-),故C正确;D.0.1 mol/L NaHS溶液存在的电离荷守恒式为c(OH-)+c(HS-)+2c(S2-)=c(H+)+ c(Na+),物料守恒式为c(Na+)=(H2S)+c(HS-)+c(S2-),则c(OH-)=c(H+)+c(H2S)-c(S2-),故D错误;答案为BC。
)>c(OH-),故C正确;D.0.1 mol/L NaHS溶液存在的电离荷守恒式为c(OH-)+c(HS-)+2c(S2-)=c(H+)+ c(Na+),物料守恒式为c(Na+)=(H2S)+c(HS-)+c(S2-),则c(OH-)=c(H+)+c(H2S)-c(S2-),故D错误;答案为BC。

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目