题目内容
用NA代表阿伏加德罗常数,下列说法正确的是( )
| A、1molCl2作为氧化剂得到的电子数为NA |
| B、在标准状况下,11.2L水中含有分子数为0.5NA |
| C、0.3mol/LNa2SO4溶液中,所含Na+和SO42-总数为0.9NA |
| D、常温压下,64gSO2中含有的原子数为3NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、1molCl2只做氧化剂转移电子2mol,自身氧化还原反应转移电子1mol;
B、标准状况水不是气体;
C、溶液体积不知不能计算微粒数;
D、依据n=
计算物质的量,结合分子式计算原子数.
B、标准状况水不是气体;
C、溶液体积不知不能计算微粒数;
D、依据n=
| m |
| M |
解答:
解:A、1molCl2只做氧化剂转移电子2mol,自身氧化还原反应,化合价0价不含为-1价和+1价,转移电子1mol,故A错误;
B、标准状况水不是气体,11.2L水物质的量不是0.5mol,故B错误;
C、溶液体积不知不能计算微粒数,故C错误;
D、依据n=
计算物质的量=
=1mol,结合分子式计算原子数为3NA,故D正确;
故选D.
B、标准状况水不是气体,11.2L水物质的量不是0.5mol,故B错误;
C、溶液体积不知不能计算微粒数,故C错误;
D、依据n=
| m |
| M |
| 64g |
| 64g/mol |
故选D.
点评:本题考查了阿伏伽德罗常数的分析应用,氧化还原反应电子转移计算,气体摩尔体积的条件分析,掌握基础是关键,题目较简单.

练习册系列答案
 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
丙烷和氯气发生取代反应生成二氯丙烷的同分异构体的数目有( )
| A、2种 | B、3种 | C、4种 | D、5种 |
下列五种烃①异戊烷②新戊烷③戊烷④丙烷⑤丁烷,按沸点由高到低的顺序排列的是( )
| A、①>②>③>④>⑤ |
| B、②>③>⑤>④>① |
| C、③>①>②>⑤>④ |
| D、④>⑤>②>①>③ |
设NA代表阿伏加德罗常数,下列说法正确的是( )
| A、22.4L O2中含有NA个氧分子 |
| B、2.4g金属镁变成镁离子时失去的电子数目为0.1NA |
| C、18g H2O所含电子数目为10NA |
| D、在25℃,压强为1.01×105Pa时,11.2L氮气所含的原子数目为NA |
与反应Cl2+SO2+2H2O=H2SO4+2HCl中水的作用完全相同的是( )
A、2H2O
| ||||
| B、Cl2+H2O=HCl+HClO | ||||
C、3Fe+4H2O(g)
| ||||
| D、2Na+2H2O=2NaOH+H2↑ |
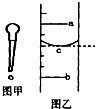 (1)图甲是实验室常用的一种仪器,其名称是
(1)图甲是实验室常用的一种仪器,其名称是