题目内容
【题目】(一)(1)用胆矾(CuSO4·5H2O)配制0.200mol/L CuSO4溶液240mL,所需要的玻璃仪器为:烧杯、量筒、________________________(要填全),应称取胆矾的质量为____________。
(2)下列操作使所配CuSO4溶液浓度偏低的是____________。
A.观察刻度线时仰视
B.观察刻度线时俯视
C.定容后倒转容量瓶几次,发现液面最低点低于标线,再补几滴水至标线
D.配制溶液前,容量瓶中有少量蒸馏水
(二)(1)用单线桥标出该反应的电子转移方向和数目,并回答相关问题:
KClO4+8HCl(浓)=KCl+4Cl2↑+4H2O____________,氧化剂与还原剂的物质的量之比为____________。
(2)配平化学方程式(将化学计量数填于空白处)
_____KMnO4+___FeSO4+___H2SO4=___K2SO4+__MnSO4+__Fe2(SO4)3+__H2O
氧化产物与还原产物的物质的量比为________。
【答案】 250mL容量瓶、胶头滴管、玻璃棒 12.5g A、C 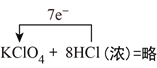 1:7 2KMnO4+10FeSO4+8H2SO4=1K2SO4+2MnSO4+5Fe2(SO4)3+8H2O 5:2
1:7 2KMnO4+10FeSO4+8H2SO4=1K2SO4+2MnSO4+5Fe2(SO4)3+8H2O 5:2
【解析】(一)(1)由于没有240mL容量瓶,则需要配制250mL,因此所需要的玻璃仪器为:烧杯、量筒、250mL容量瓶、胶头滴管、玻璃棒,应称取胆矾的质量为0.25L×0.2mol/L×250g/mol=12.5g。(2)A.观察刻度线时仰视,液面高于刻度线,浓度偏低;B.观察刻度线时俯视液面低于刻度线,浓度偏高;C.定容后倒转容量瓶几次,发现液面最低点低于标线,再补几滴水至标线,溶液体积增加,浓度偏低;D.配制溶液前,容量瓶中有少量蒸馏水不影响,答案选AC。
(二)(1)高氯酸钾中氯元素化合价从+7价降低到0价,氯化氢中氯元素的化合价从-1价升高到0价,所以根据电子得失守恒可知氧化剂与还原剂的物质的量之比为1:7,其中用单线桥标出该反应的电子转移方向和数目为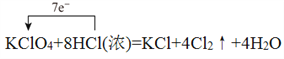 。(2)反应中Mn元素化合价从+7价降低到+2价,得到5个电子。铁元素化合价从+2价升高到+3价,失去1个电子,根据电子得失守恒和原子守恒可知配平后的方程式为2KMnO4+10FeSO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,其中氧化产物与还原产物的物质的量比为5:2。
。(2)反应中Mn元素化合价从+7价降低到+2价,得到5个电子。铁元素化合价从+2价升高到+3价,失去1个电子,根据电子得失守恒和原子守恒可知配平后的方程式为2KMnO4+10FeSO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,其中氧化产物与还原产物的物质的量比为5:2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案