题目内容
【题目】300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
(1)300℃时,该反应的平衡常数表达式为K=______________,已知K300℃<K350℃,则ΔH____0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率________(填“增大”“减小”或“不变”)。
【答案】 略 > 0.8 mol/L 0.2 mol·L-·min-1 不变
【解析】(1)根据方程式可知该反应的平衡常数表达式为K=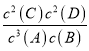 ;已知K300℃<K350℃,这说明升高温度平衡常数增大,反应向正反应方向进行,因此正反应是吸热反应,则ΔH>0。(2)在2 min末时,生成0.8 mol D ,消耗B是0.4mol,剩余B是1.6mol,B的平衡浓度为1.6mol/2L=0.8 mol/L;D的平均反应速率为0.8mol/(2L·2min)=0.2mol/(L·min)。(3)反应前后体积不变,若温度不变,缩小容器容积,平衡不移动,A的转化率不变。
;已知K300℃<K350℃,这说明升高温度平衡常数增大,反应向正反应方向进行,因此正反应是吸热反应,则ΔH>0。(2)在2 min末时,生成0.8 mol D ,消耗B是0.4mol,剩余B是1.6mol,B的平衡浓度为1.6mol/2L=0.8 mol/L;D的平均反应速率为0.8mol/(2L·2min)=0.2mol/(L·min)。(3)反应前后体积不变,若温度不变,缩小容器容积,平衡不移动,A的转化率不变。

练习册系列答案
相关题目