题目内容
含6.02×1023个原子的氧气在标准状况下所占的体积约为
| A.44.8 L | B.22.4 L | C.11.2 L | D.5.6 L |
C
试题分析:根据
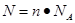 可知,含6.02×1023个原子的氧气的物质的量是0.5mol,则在标准状况下的体积是0.5mol×22.4L/mol=11.2L,答案选C。
可知,含6.02×1023个原子的氧气的物质的量是0.5mol,则在标准状况下的体积是0.5mol×22.4L/mol=11.2L,答案选C。点评:在进行物质的量的有关计算时,关键是熟练应用几个关系式
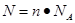 、n=m/M、
、n=m/M、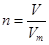 、
、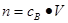 ,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
练习册系列答案
相关题目
 g
g g
g g
g ,求消耗的
,求消耗的 的物质的量。(3分)
的物质的量。(3分)