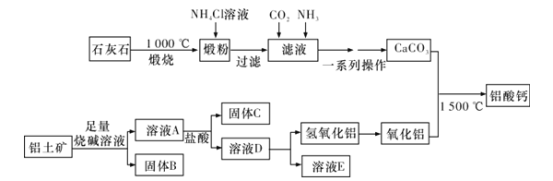
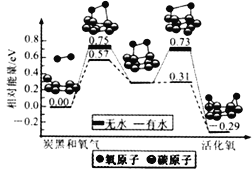
题目内容
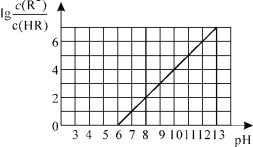
【题目】对于反应2SiHCl3(g)= SiH2Cl2(g)+SiCl4(g) ΔH1=+48 kJ·mol-1,采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
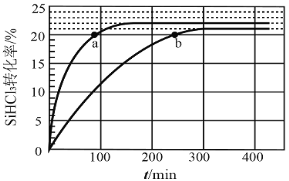
①343 K时反应的平衡转化率α=_________%。平衡常数K343 K=__________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是__________,要缩短反应达到平衡的时间,可采取的措施有_____________。
③比较a、b处反应速率大小:υa______υb(填“大于”“小于”或“等于”)。反应速率υ=υ正υ逆=![]() ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处![]() =________(保留1位小数)。
=________(保留1位小数)。
【答案】22 0.02 及时分离出产物 增大压强、使用催化剂或增大反应物的浓度等 大于 1.3
【解析】
①直接观察即可知343K时的平衡转化率,再根据转化率列出三段式,进而求出平衡常数K;
②影响平衡的因素有温度、压强及浓度等,可根据反应条件判断促进平衡正向移动,提高转化率的方法;要缩短反应达到平衡的时间,需要提高反应速率,而影响反应速率的因素主要有温度、浓度、压强及催化剂等。
③温度越高,反应速率越快,由图象观察a处和b处的温度大小比较即可;反应速率υ=υ正υ逆=![]() ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数则a点时υ正=
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数则a点时υ正=![]() ,υ逆=
,υ逆=![]() ,由平衡时正逆反应速率相等,可得出
,由平衡时正逆反应速率相等,可得出![]() ,再结合此温度下的平衡状态,计算出平衡常数K即可计算
,再结合此温度下的平衡状态,计算出平衡常数K即可计算![]() 。
。
温度越高,反应速率越快,图象中点a所在曲线为343K,由图示可知343K时反应![]() 的平衡转化率α=22%,设SiHCl3的起始浓度为cmol/L,则
的平衡转化率α=22%,设SiHCl3的起始浓度为cmol/L,则

平衡常数![]() ,
,
故答案为:22;0.02;
②由题目中前后反应气体体积不变,并且温度恒定,所以只能使用及时分离出产物的方法加大反应物的转化率;要缩短反应达到的时间,应增大反应速率,则在温度不变的条件下可采取的措施是:增大压强、使用催化剂或增大反应物的浓度等,故答案为:及时分离出产物;增大压强、使用催化剂或增大反应物的浓度等;
③由图象可知,a的反应温度高于b,温度高反应速率快,所以a点的反应速率比b高;a点时转化率为20%,设起始时SiHCl3的物质的量为nmol,此时
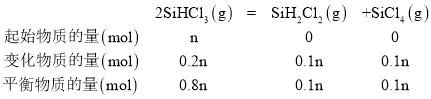
则:![]() ,
,![]() ;反应速率υ=υ正υ逆=
;反应速率υ=υ正υ逆=![]() ,k正、k逆分别为正、逆向反应速率常数,则a点时
,k正、k逆分别为正、逆向反应速率常数,则a点时![]() ,
,![]() ,由平衡时正逆反应速率相等,可得出
,由平衡时正逆反应速率相等,可得出![]() (平衡常数),则
(平衡常数),则![]() ,故答案为:大于;1.3。
,故答案为:大于;1.3。

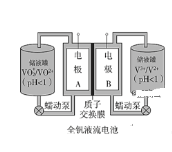
【题目】全钒液流电池是一种新型的绿色环保储能系统,工作原理如图:
离子种类 | VO2+ | VO2+ | V3+ | V2+ |
颜色 | 黄色 | 蓝色 | 绿色 | 紫色 |
(1)全钒液流电池放电时V2+发生氧化反应,该电池放电时总反应式是__________。
(2)当完成储能时,正极溶液的颜色是________
(3)质子交换膜的作用是____________