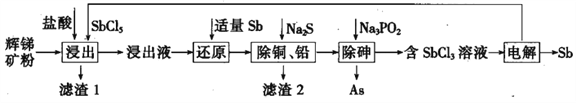
题目内容
【题目】两种无色溶液混合后仍然为无色透明溶液,混合后的溶液中可能存在的离子组合为
A.Mg2+、SO42-、K+、Cl-B. Na+、NH4+、NO3-、Fe3+
C. K+、Cu2+、Cl-、Br-D. Ba2+、Na+、OH-、SO42-
【答案】A
【解析】
离子之间不反应即能共存,注意无色溶液排除有色离子Cu2+、Fe2+、MnO4-等离子。
A. Mg2+、SO42-、K+、Cl-离子之间不反应能共存,且溶液为无色,A符合题意;
B. Fe3+黄色,B不符合题意;
C. Cu2+蓝色,C不符合题意;
D. Ba2+和SO42-反应,生成BaSO4沉淀,不能大量共存,D不符合题意。
答案选A。

【题目】研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1) 氧化还原法消除NOx的转化如下:
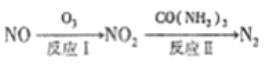
已知: NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ/mol
2NO(g)+O2(g)=2NO(g) △H=-116.2kJ/mol
则NO 与O3 只生成NO2 的热化学方程式为_____________________。
(2) 有人设想将CO按下列反应除去: 2CO(g)=2C(s)+O2(g) △H>0,请你分析该反应能否自发进行?_____( 填“是”或“否”),依据是_____________________。
(3)活性炭也可用于处理汽车尾气中的NO。在2L.恒容密闭容器中加入0.1000mo1NO和2.030mol 固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如下表:
固体活性炭/mol | NO/mol | A/mol | B/mol | |
200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 |
335℃ | 2.005 | 0.0500 | 0.0250 | 0.0250 |
①结合上表的数据,写出NO与活性炭反应的化学方程式______ 该反应的正反应为_______(填”吸热”或“放热”)反应。
②200℃时,平衡后向恒容容器中再充入0.1000mo1NO,再次平衡后,NO 的体积分数将____。(填“增大”、“减小”或“不变”)。
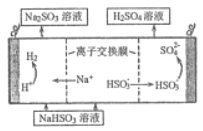
(4) 用亚硫酸钠溶液吸收二氧化硫得到亚硫酸氢钠溶液,然后电解该溶液可制得硫酸,电解原理示意图如图所示。请写出开始时阳极的电极反应式______________。
(5)常温下,Ksp(BaCO3) =2.5×10-9,Ksp(BaSO4) =1.0×10-10,控制条件可实现如下沉淀转换:
BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq) ,该反应平衡常数K的表达式为:K=_______,欲用1LNa2CO3 溶液将0.01molBaSO4 全部转化为BaCO3,则Na2CO3 溶液的最初浓度应不低于_________。
【题目】合金与铁的物理性质的比较如下表所示:
熔点 | 密度 | 硬度 | 导电性 | |
某合金 | 2500 | 3.00 | 7.4 | 2.3 |
铁 | 1535 | 7.86 | 4.5 | 17 |
又知该合金耐腐蚀,强度大.从以上性能看,该合金不适合用作( )
A.导线
B.门窗框
C.炉具
D.飞机外壳