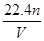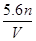题目内容
(10分)将35.8gNa2CO3和NaHCO3的固体混合物溶于足量水中,向其中逐滴加入1mol·L-1的盐酸至不再产生气体为止,测得共产生CO28.96L(标准状况)(气体溶解忽略不计)。回答:
⑴原混合物中Na2CO3为 _______________g
⑵若以滴加盐酸的体积为V(mL),产生气体的物质的量为n(mol),建立n=f(V)的函数关系,将V在不同取值时,n=f(V)的关系式填入下表并作图

⑴原混合物中Na2CO3为 _______________g
⑵若以滴加盐酸的体积为V(mL),产生气体的物质的量为n(mol),建立n=f(V)的函数关系,将V在不同取值时,n=f(V)的关系式填入下表并作图
| V值 | n=f(V) |
| | |
| | |
| | |

(1)10.6 (2分) (2)(表中每空1分,共6分,图2分)

| V值 | n=f(V) |
| v≤100 | n=0 |
| 100<V<500 | n=10-3V—0.1 |
| V≥500 | n=0.4 |

(1)设原混合物中Na2CO3和NaHCO3的质量分别是x和y,则106x+84y=35.8,x+y= ,解得x=0.1mol,y=0.3mol。所以碳酸钠的质量是10.6g。
,解得x=0.1mol,y=0.3mol。所以碳酸钠的质量是10.6g。
(2)由于碳酸钠和盐酸反应是分步进行的,方程式为Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑。由于碳酸钠是0.1mol,则恰好生成碳酸氢钠时,需要盐酸是100ml。如果完全放出CO2则需要盐酸是500ml,因此答案是
 ,解得x=0.1mol,y=0.3mol。所以碳酸钠的质量是10.6g。
,解得x=0.1mol,y=0.3mol。所以碳酸钠的质量是10.6g。(2)由于碳酸钠和盐酸反应是分步进行的,方程式为Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑。由于碳酸钠是0.1mol,则恰好生成碳酸氢钠时,需要盐酸是100ml。如果完全放出CO2则需要盐酸是500ml,因此答案是
| V值 | n=f(V) |
| v≤100 | n=0 |
| 100<V<500 | n=10-3V—0.1 |
| V≥500 | n=0.4 |

练习册系列答案
相关题目