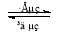题目内容
加碘食盐中加入的碘酸钾是一种白色结晶粉末,其溶解度受温度影响很大,且随温度的升高而逐渐增大,常温下很稳定,在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物等还原性物质发生反应。
(1)为检验某食盐中是否含有KIO3,某同学取食盐样品完全溶解于水中,然后加入用盐酸酸化的淀粉KI溶液,结果溶液呈蓝色,则反应的离子方程式为 ;
(2)KIO3也可用电解的方法制得,其原理是以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O=KIO3+3H2↑,则两极的电极反应式分别为:阴极 ,阳极 。
(1)5I- + IO3- + 6H+ = 3I2 + 3H2O
(2)6H+ + 6e- = 3H2↑ I- - 6e- + 6OH- = IO3- + 3H2O
【解析】
试题分析:(1)KIO3与盐酸酸化的淀粉KI溶液发生氧化还原反应生成碘单质,遇淀粉变蓝,离子反应为5I-+IO3-+6H+=3I2+3H2O,故答案为:5I-+IO3-+6H+=3I2+3H2O;
(2)总反应方程式为KI+3H2O=KIO3+3H2↑,I元素的化合价升高,发生氧化反应,则在阳极生成碘酸钾,阳极反应为I--6e-+6OH-=IO3-+3H2O;H元素的化合价降低,则在阴极生成氢气,阴极反应为6H++6e-=3H2↑,
故答案为:6H++6e-=3H2↑;I--6e-+6OH-=IO3-+3H2O.
考点:考查氧化还原反应及电解

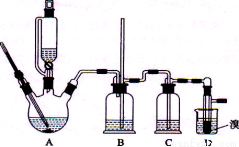
实验室用少量的溴水和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1) 烧瓶A中发生的主要的反应方程式: 。
(2) 安全瓶B可以防倒吸,并可以检查实验进行时试管D是否发生堵塞。请写出发生堵塞时瓶B中的现象: 。
(3) 在装置C中应加入 (填字母) ,其目的是
a.水 b.浓硫酸 c.氢氧化钠溶液
(4)若产物中有少量未反应的Br2,最好用 洗涤除去。(填字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(5)若产物中有少量副产物乙醚,可用 的方法除去。
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是 。