题目内容
下表列出了①~⑤五种元素在周期表中的位置:

请按要求回答下列问题:
(1)元素④的原子结构示意图为______.
(2)元素①和③形成的化合物中的化学键是______共价键(填“极性”或“非极性”).
(3)元素①单质的电子式为______.
(4)元素②~⑤的原子半径由大到小的顺序为(填元素符号)______,它们的最高价氧化物对应的水化物中,酸性最强的是______(填化学式).
(5)元素②的单质在氧气中燃烧的产物与二氧化碳反应的化学方程式为______;元素③的最高价氧化物与烧碱溶液反应的离子方程式为______.

请按要求回答下列问题:
(1)元素④的原子结构示意图为______.
(2)元素①和③形成的化合物中的化学键是______共价键(填“极性”或“非极性”).
(3)元素①单质的电子式为______.
(4)元素②~⑤的原子半径由大到小的顺序为(填元素符号)______,它们的最高价氧化物对应的水化物中,酸性最强的是______(填化学式).
(5)元素②的单质在氧气中燃烧的产物与二氧化碳反应的化学方程式为______;元素③的最高价氧化物与烧碱溶液反应的离子方程式为______.
根据元素在周期表中的位置知,①②③④⑤分别是N、Na、Si、S、Cl元素,
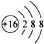
(1)元素④的原子核外有3个电子层,K、L、M电子层上电子数分别是2、8、6,其原子结构示意图为: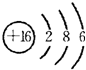 ,
,
故答案为: ;
;
(2)元素①和③形成的化合物是Si3N4,氮化硅中N和Si原子之间存在极性共价键,故答案为:极性;
(3)元素①单质是N2,氮原子之间存在氮氮三键,其电子式为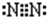 ,故答案为:
,故答案为: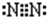 ;
;
(4)同一周期元素中,元素原子半径随着原子序数的增大而减小,所以原子半径大小顺序是Na>Si>S>Cl;同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,这几种元素非金属性最强的元素是Cl元素,所以酸性最强的酸是HClO4,
故答案为:Na>Si>S>Cl;HClO4;
(5)Na在氧气中燃烧生成Na2O2,Na2O2与CO2反应生成Na2CO3和O2,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2;元素③的最高价氧化物是SiO2,SiO2与NaOH溶液反应生成Na2SiO3和H2O,离子反应方程式为:SiO2+2OH-=SiO32-+H2O,故答案为:2Na2O2+2CO2=2Na2CO3+O2;SiO2+2OH-=SiO32-+H2O.
(1)元素④的原子核外有3个电子层,K、L、M电子层上电子数分别是2、8、6,其原子结构示意图为:
 ,
,故答案为:
 ;
;(2)元素①和③形成的化合物是Si3N4,氮化硅中N和Si原子之间存在极性共价键,故答案为:极性;
(3)元素①单质是N2,氮原子之间存在氮氮三键,其电子式为
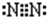 ,故答案为:
,故答案为: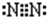 ;
;(4)同一周期元素中,元素原子半径随着原子序数的增大而减小,所以原子半径大小顺序是Na>Si>S>Cl;同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,这几种元素非金属性最强的元素是Cl元素,所以酸性最强的酸是HClO4,
故答案为:Na>Si>S>Cl;HClO4;
(5)Na在氧气中燃烧生成Na2O2,Na2O2与CO2反应生成Na2CO3和O2,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2;元素③的最高价氧化物是SiO2,SiO2与NaOH溶液反应生成Na2SiO3和H2O,离子反应方程式为:SiO2+2OH-=SiO32-+H2O,故答案为:2Na2O2+2CO2=2Na2CO3+O2;SiO2+2OH-=SiO32-+H2O.

练习册系列答案
相关题目