题目内容
【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS等)来制备,其工艺流程如下:

回答下列问题:
(1)“浸泡除铝”时,发生反应的化学方程式为___________。
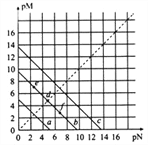
(2)“溶解”时放出的气体为________(填化学式)。硫酸镍溶液可用于制备合成氨的催化剂ConNi(1-n)Fe2O4。如图表示在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线,由图分析可知Co2+、Ni2+两种离子中催化效果更好的是________________。

(3)“氧化”时,酸性条件下,溶液中的Fe2+被氧化为Fe3+,其离子方程式为。
(4)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH1”时,溶液pH范围为________;过滤2所得滤渣的成分________(填化学式)。
(5)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式________________。
(6)含镍金属氢化物MH-Ni燃料电池是一种绿色环保电池,广泛应用于电动汽车。其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液。它的充、放电反应为:xNi(OH)2+M![]() MHx+xNiOOH;电池充电过程中阳极的电极反应式为________;放电时负极的电极反应式为________。
MHx+xNiOOH;电池充电过程中阳极的电极反应式为________;放电时负极的电极反应式为________。
【答案】 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ H2和H2S Co2+ 2Fe2++ClO-+2H+ = 2Fe3++Cl-+H2O 5.6~6.2 Cr(OH)3和Fe(OH)3 4Ni(OH)2+O2 = 4NiOOH+2H2O Ni(OH)2+OH--e-=NiOOH+H2O 、 MHx + xOH--xe- = M + xH2O
【解析】由流程可知,废镍催化剂(主要含Ni、Al,少量Cr、FeS等)加氢氧化钠碱浸,Al溶解:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,过滤得到固体含有Ni、Cr、FeS,加入稀硫酸酸浸溶解,溶液含有Ni2+、Fe2+、Cr2+,加入NaClO氧化亚铁离子为铁离子,加入Ni(OH)2调节溶液PH使Fe3+和Cr2+全部沉淀,镍离子不沉淀,过滤后调节溶液PH得到Ni(OH)2沉淀,通过蒸发浓缩,冷却结晶,过滤洗涤得到NiSO47H2O晶体,在加热条件下与空气反应得到碱式氧化镍(NiOOH)。
(1)“浸泡除铝”时,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑;故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;(2)“溶解”时为Ni、Cr、FeS与稀硫酸反应,Ni+H2SO4═NiSO4+H2↑、Cr+H2SO4═CrSO4+H2↑、FeS+H2SO4═NiSO4+H2S↑;由图可知,随n值越大,合成氨的相对初始速率越大,而n增大,Co2+的比例增大,故Co2+的催化活性更高,故答案为:H2、H2S;Co2+;(3)“氧化1”时,酸性条件下,溶液中的Fe2+被NaClO氧化为Fe3+,其离子方程式为:ClO-+2Fe2++2H+=2Fe3++Cl-+2H2O;故答案为:ClO-+2Fe2++2H+=2Fe3++Cl-+2H2O;(4)加入Ni(OH)2调节溶液PH使Fe3+和Cr2+全部沉淀,镍离子不沉淀,故pH范围为5.6~6.2;故答案为:5.6~6.2;Cr(OH)2和Fe(OH)3;(5)在加热条件下Ni(OH)2与空气反应得到碱式氧化镍(NiOOH),化学方程式为:4Ni(OH)2+O2![]() 4NiOOH+2H2O;故答案为:4Ni(OH)2+O2
4NiOOH+2H2O;故答案为:4Ni(OH)2+O2![]() 4NiOOH+2H2O;(6)阳极电极反应方程式为:Ni(OH)2+OH--e-=NiOOH+H2O;放电为原电池,负极失去电子,发生氧化反应,电极反应方程式为:MHx+xOH--xe-=M++xH2O,故答案为:Ni(OH)2+OH--e-=NiOOH+H2O;MHx+xOH--xe-=M++xH2O。
4NiOOH+2H2O;(6)阳极电极反应方程式为:Ni(OH)2+OH--e-=NiOOH+H2O;放电为原电池,负极失去电子,发生氧化反应,电极反应方程式为:MHx+xOH--xe-=M++xH2O,故答案为:Ni(OH)2+OH--e-=NiOOH+H2O;MHx+xOH--xe-=M++xH2O。

 名校课堂系列答案
名校课堂系列答案