题目内容
【题目】合成氨时,在某个密闭容器中发生反应:3H2(g)+N2(g)![]() 2NH3(g)
2NH3(g)
(1)下列能使反应速率加快的是_____________________
①升高温度 ②减小容器体积 ③通入N2 ④通入Ar使压强增大 ⑤通入HCl气体 ⑥加入合适的催化剂
A.①③④⑤ B.①②③⑥ C.①②③④ D.②④⑤⑥
(2)在恒温、恒容的条件下,下列说法能表示反应达到化学平衡状态的是__________
①当有1molN2被消耗,就有2molNH3生成
②当有6molH—H键形成时,就有12molN—H键形成
③2![]() 正(N2)=
正(N2)=![]() 逆(NH3)
逆(NH3)
④N2的物质的量不再变化
⑤H2、N2、NH3的浓度之比等于3:1:2
⑥混合气体的密度不变
⑦混合气体的压强不变
⑧混合气体的平均相对分子质量不变
A.①③④⑤⑦ B.①②③④⑧ C.②③④⑦⑧ D.②④⑤⑥
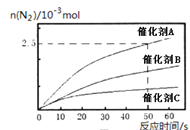
(3)在2 L定容密闭容器中通入1 mol N2(g)和3 mol H2(g),发生反应:3H2(g)+N2(g)![]() 2NH3(g)(放热反应)。测得压强-时间图像如图甲,测得p2=0.8p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如图乙图像。
2NH3(g)(放热反应)。测得压强-时间图像如图甲,测得p2=0.8p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如图乙图像。

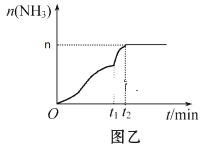
①如图甲,反应开始至平衡时NH3的平均反应速率为_____________________,平衡时氢气的转化率为_________。
②如图乙,下列说法正确的是_________
A.t1时刻可能是加入了催化剂
B.改变条件可以使H2 100℅转化为NH3
C.增大N2的浓度,可以提高H2的转化率
D.t2时刻,N2的浓度与NH3的浓度之比为1:2
【答案】B C 0.08mol/(L·min) 40% AC
【解析】
根据题意,本题考查化学反应速率、化学平衡的判断、化学平衡移动、图像的分析,运用![]() 、勒夏特里原理分析。
、勒夏特里原理分析。
(1)①升高温度,可以加快反应速率,①正确;
②减小容器体积,相当增大压强,反应物和生成物浓度增大,反应速率加快,②正确;
③通入N2 ,增大反应物浓度,反应速率加快,③正确;
④通入Ar使压强增大 ,反应物和生成物浓度不变,反应速率不变,④错误;
⑤通入HCl气体,会与NH3生成NH4Cl,使生成物浓度降低,反应速率减慢,⑤错误;
⑥加入合适的催化剂可以加快反应速率,⑥正确;
故答案:B;
(2)①1molN2被消耗和2molNH3生成 均指正反应速率,不能判断是否达到平衡,①错误;
②当有6molH—H键形成时,就有12molN—H键形成 ,此时![]() 正=
正=![]() 逆,反应达到平衡状态,②正确;
逆,反应达到平衡状态,②正确;
③2![]() 正(N2)=
正(N2)=![]() 逆(NH3),此时
逆(NH3),此时![]() 正=
正=![]() 逆,反应达到平衡状态,③正确;
逆,反应达到平衡状态,③正确;
④反应过程中N2的物质的量会发生变化,当N2的物质的量不再变化时,![]() 正=
正=![]() 逆,反应达到平衡状态,④正确;
逆,反应达到平衡状态,④正确;
⑤非平衡时候H2、N2、NH3的浓度之比也可以等于3:1:2,因此H2、N2、NH3的浓度之比等于3:1:2时不能判断是否达到平衡,⑤错误;
⑥在恒温、恒容的条件下,混合气体的密度始终保持不变,因此混合气体的密度不变时不能判断是否达到平衡,⑥错误;
⑦反应3H2(g)+N2(g)![]() 2NH3(g)前后气体分子数不相同,在恒温、恒容的条件下,混合气体的压强会发生变化,因此混合气体的压强不变时,反应达到平衡,⑦正确;
2NH3(g)前后气体分子数不相同,在恒温、恒容的条件下,混合气体的压强会发生变化,因此混合气体的压强不变时,反应达到平衡,⑦正确;
⑧反应3H2(g)+N2(g)![]() 2NH3(g)前后气体分子数不相同,在恒温、恒容的条件下,混合气体的平均相对分子质量会发生变化,当混合气体的平均相对分子质量不变时,反应达到平衡,⑧正确;
2NH3(g)前后气体分子数不相同,在恒温、恒容的条件下,混合气体的平均相对分子质量会发生变化,当混合气体的平均相对分子质量不变时,反应达到平衡,⑧正确;
故答案为:C;
(3)①假设反应过程中NH3变化的物质的量为2x,则

由p2=0.8p1和反应前后压强比等于气体物质的量之比可知,![]() ,解得x=0.4mol,反应开始至平衡时NH3的平均反应速率为
,解得x=0.4mol,反应开始至平衡时NH3的平均反应速率为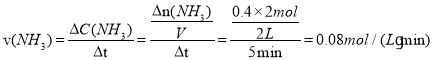 ,平衡时氢气的转化率
,平衡时氢气的转化率![]() ;
;
故答案为:0.08mol/(L·min);40%;
②A.t1时刻改变条件后生成NH3反应速率加快,可能是加入了催化剂,A项正确;
B.可逆反应不能达到 100℅转化,B项错误;
C.增大N2的浓度,平衡向正方向移动,可以提高H2的转化率,C项正确;
D.t2时刻,反应达到平衡状态,此时N2的浓度与NH3的浓度之比不一定为1:2,D项错误;
故答案为:AC。

【题目】下列反应中,生成物所贮的化学能比反应物所贮化学能要多的是( )
A.CaO+H2O=Ca(OH)2
B.NaOH+HCl=NaCl+H2O
C.CH4+2O2 ![]() CO2+2H2O
CO2+2H2O
D.CO2+C ![]() 2CO
2CO
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

下列说法不正确的是
A.“酸浸”后,若钛主要以TiOCl42-形式存在,则相应反应的离子方程式可表示为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
B.若Li2Ti5O15中Ti的化合价为+4,则其中过氧键的数目为3个
C.“高温煅烧②”中由FePO4制备LiFePO4的化学方程式可表示为:2FePO4+Li2CO3+H2C2O4![]() 2LiFeO4+H2O↑+3CO2↑
2LiFeO4+H2O↑+3CO2↑
D.TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
可知,40℃前,未达到平衡状态,随着温度升高,转化率变大
【题目】如表是A、B、C、D四种常见有机物的相关信息。
有机物A | 有机物B | 有机物C | 有机物D |
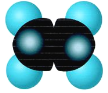
①可用于果实催熟 ②比例模型为 | ①由C、H两种元素组成 ②球棍模型为 | ①生活中常见的液态有机物,分子中碳原子数与有机物A相同, ②能与Na反应,但不能与NaOH反应 | ①相对分子质量比有机物C大14 ②能由有机物C氧化生成 |
根据表中信息回答下列问题:
(1)有机物A的分子式为________。
(2)下列有关有机物A、B的说法正确的是________(填字母)。
a.A、B均可使酸性KMnO4溶液褪色
b.A、B分子中所有的原子在同一平面内
c.等质量的A、B完全燃烧,消耗氧气的量相同
d.A、B分子均含有碳碳双键,能发生加成反应
(3)写出有机物C的同分异构体的结构简式:________。
(4)在一定条件下,有机物C与有机物D反应能生成具有水果香味的物质E,其化学反应方程式为_______,某次实验中,以5.0gD为原料,制得4.4gE,则D的转化率为_____。