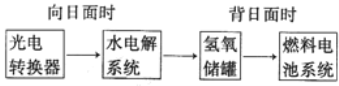
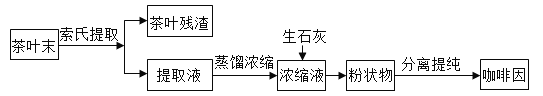
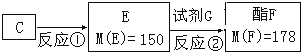题目内容
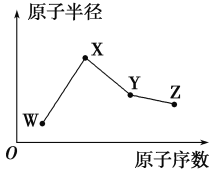
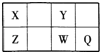
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X、Y、W、Q四种元素的原子最外层电子数之和为23。则下列说法中正确的是( )
A. 钠与W形成的化合物Na2W2中既含离子键又含非极性共价键
B. 由Z与Y组成的物质在熔融时能导电
C. 氢化物的沸点:Y<Q
D. X有多种同素异形体,而Y不存在同素异形体
【答案】A
【解析】
由短周期元素X、Y、Z、W、Q在元素周期表中的位置可知,X、Y处于第二周期,Z、W、Q处于第三周期,X、Y、W、Q四种元素的原子最外层电子数之和为23,假设X的最外层电子数为a,则Y、W最外层电子数为a+2,Q最外层电子数为a+3,a+2(a+2)+(a+3)=23,解得a=4,X最外层含有4个电子,X为C元素,结合各元素在周期表中的相对位置可知:Z为Si元素、Y为O元素、W为S元素、Q为Cl元素,据此分析解答。
根据分析可知,X为C元素、Z为Si元素、Y为O元素、W为S元素、Q为Cl元。
A.Na和S可形成类似于Na2O2的化合物Na2S2,A正确;
B.Z和Y组成的物质为二氧化硅,二氧化硅属于原子晶体,原子间以共价键结合,无离子,因此在熔融状态下不导电,B错误;
C.H2Y、HQ分别为H2O、HCl,H2O分子之间存在氢键,增加了分子之间的吸引力,使水的沸点比HCl的高,C错误;
D.C元素有金刚石、石墨等多种同素异形体,O元素存在氧气、臭氧两种同素异形体,所以C、O元素都存在同素异形体,D错误;
故合理选项是A。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目