题目内容
3.下列关于甲烷性质的说法中,错误的是( )| A. | 甲烷是共价化合物 | B. | 甲烷分子具有正四面体结构 | ||
| C. | 甲烷分子具有极性键 | D. | 甲烷分子中H-C-H的键角为90℃ |
分析 甲烷为C与H形成的共价化合物,甲烷分子中,碳原子采取sp3杂化,4个碳氢键完全相同,故甲烷为正四面体结构,其中H-C-H的键角为109°28′,据此解答即可.
解答 解:A、甲烷为C与H形成的共价化合物,故A正确;
B、甲烷分子中,碳原子采取sp3杂化,4个碳氢键完全相同,故甲烷为正四面体结构,故B正确;
C、甲烷分子中仅存在C-H极性共价键,故C正确;
D、甲烷为正四面体结构,其中H-C-H的键角为109°28′,不是90°,故D错误,
故选D.
点评 甲烷分子中,碳原子采取sp3杂化,4个碳氢键完全相同,决定了甲烷分子为正四面体结构,可以根据教材知识来回答,难度不大.

练习册系列答案
相关题目
13.1993年的世界十大科技新闻称:中国学者许志福和美国科学家穆尔共同合成了世界上最大的碳氢分子,其中1个分子由1134个碳原子和1146个氢原子构成.关于此物质,下列说法错误的是( )
| A. | 是烃类化合物 | B. | 常温下呈固态 | ||
| C. | 具有类似金刚石的硬度 | D. | 易被氧化 |
14.已知钋的原子序数是84,是一种放射性元素,被称为世界上最毒的物质,是推测它在周期表的位置( )
| A. | 第四周期第ⅢA族 | B. | 第六周期第ⅥA族 | C. | 第五周期第ⅥA族 | D. | 第六周期第ⅦA族. |
11.有机物X的分子式为C5H11Cl,用NaOH的醇溶液处理X,可得到分子式为C5H10的两种产物Y、Z.Y、Z经催化加氢后都可得到2-甲基丁烷.则X的结构简式可能为( )
| A. | CH3CH2CH2CH2CH2Cl | B. |  | ||
| C. |  | D. | 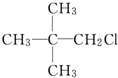 |
18.下列叙述正确的是( )
| A. | 二氧化碳与碳化合生成一氧化碳是放热反应 | |
| B. | 给手机电池充电的过程,是将化学能转变为电能的过程 | |
| C. | 甲烷燃烧是将热能转变为电能的过程 | |
| D. | 反应物的总能量大于生成物的总能量的反应一定是放热反应 |
12.X、Y、M、N是短周期主族元素,且原子序数依次增大.已知X的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大.下列说法正确的是( )
| A. | M与X形成的化合物对应的水化物一定是强酸 | |
| B. | Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同 | |
| C. | X、Y的简单离子半径:r(X2-)>r(Y+) | |
| D. | X的气态氢化物比M的气态氢化物稳定 |
13.下列对于硝酸的认识,不正确的是( )
| A. | 浓硝酸和稀硝酸都具有氧化性 | |
| B. | 铜与浓硝酸的反应是置换反应 | |
| C. | 常温下,可用铁或铝制容器盛放浓HNO3 | |
| D. | 往少量的浓硝酸中加入足量的铜,生成的气体只有NO2 |
 和
和
 和
和


 .
. ;⑤n CH2=CHCH2COOH$\stackrel{催化剂}{→}$
;⑤n CH2=CHCH2COOH$\stackrel{催化剂}{→}$ .
. .
.