题目内容
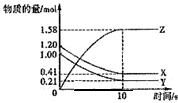
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图1所示:
(1)从反应开始到10s时,用Z表示的反应速率为
(2)该反应的化学方程式为
A.t1时刻,增大了X的浓度
B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积
D.t1时刻,使用了催化剂.

(1)从反应开始到10s时,用Z表示的反应速率为
0.079mol/(L?s)
0.079mol/(L?s)
.(2)该反应的化学方程式为
X(g)+Y(g) 2Z(g)
2Z(g)
 2Z(g)
2Z(g)X(g)+Y(g) 2Z(g)
2Z(g)
.(3)10s后的某一时刻(t1)改变了外界条件,其率随时间的变化图象如图2所示:则下列说法符合该图象的是 2Z(g)
2Z(g)C、D
C、D
.A.t1时刻,增大了X的浓度
B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积
D.t1时刻,使用了催化剂.
分析:(1)根据v=
计算反应速率;
(2)根据物质的量的变化与化学计量数呈正比书写化学方程式.
(3)由图象可知正逆反应速率增大,平衡没移动.
| △c |
| △t |
(2)根据物质的量的变化与化学计量数呈正比书写化学方程式.
(3)由图象可知正逆反应速率增大,平衡没移动.
解答:解:(1)ν(X)=
=0.079mol/(L?s),故答案为:0.079mol/(L?s);
(2)由图象可以看出,反应到10s时,X的物质的量减小,变化值为1.20mol-0.41mol=0.79mol,
Y的物质的量减小,变化值为1.0mol-0.21mol=0.79mol,则X、Y为反应物,
Z的物质的量增多,变化值为1.58mol,为生成物,
根据物质的量的变化与化学计量数呈正比,
则有n(X):n(Y):n(Z)=0.79mol:0.79mol:1.58mol=1:1:2,
所以反应的方程式为X(g)+Y(g) 2Z(g),
2Z(g),
故答案为:X(g)+Y(g) 2Z(g);
2Z(g);
(3)由图象可知正逆反应速率增大,平衡没移动;
A.t1时刻,增大了X的浓度,平衡正移,不符合题意,故A错误;
B.t1时刻,升高了体系温度,平衡移动,不符合题意,故B错误
C.t1时刻,缩小了容器体积,速率增大,由于反应前后计量数相等,平衡不移动,符合题意,故C正确;
D.t1时刻,使用了催化剂,速率增大,平衡不移动,符合题意,故D正确;
故答案为:C、D.
| ||
| 10s |
(2)由图象可以看出,反应到10s时,X的物质的量减小,变化值为1.20mol-0.41mol=0.79mol,
Y的物质的量减小,变化值为1.0mol-0.21mol=0.79mol,则X、Y为反应物,
Z的物质的量增多,变化值为1.58mol,为生成物,
根据物质的量的变化与化学计量数呈正比,
则有n(X):n(Y):n(Z)=0.79mol:0.79mol:1.58mol=1:1:2,
所以反应的方程式为X(g)+Y(g)
 2Z(g),
2Z(g),故答案为:X(g)+Y(g)
 2Z(g);
2Z(g);(3)由图象可知正逆反应速率增大,平衡没移动;
A.t1时刻,增大了X的浓度,平衡正移,不符合题意,故A错误;
B.t1时刻,升高了体系温度,平衡移动,不符合题意,故B错误
C.t1时刻,缩小了容器体积,速率增大,由于反应前后计量数相等,平衡不移动,符合题意,故C正确;
D.t1时刻,使用了催化剂,速率增大,平衡不移动,符合题意,故D正确;
故答案为:C、D.
点评:本题考查反应速率的计算平衡图象问题,题目难度不大,注意把握物质的量的变化与化学计量数呈正比,以此书写化学方程式.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
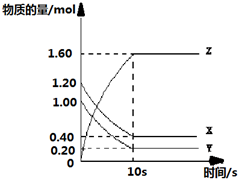
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是( )| A、反应开始到10s,用Z表示的反应速率为0.158moL/(L?s) | B、l0s后,该反应停止进行 | C、反应的化学方程式为:X(g)+Y(g)?2Z(g) | D、反应开始到l0s时,平均反应速率ν(X)=ν(Y)=0.0395mol/(L?s) |
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示: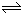 2Z(g)
2Z(g)
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.回答下列问题:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.回答下列问题: 2Z
2Z