题目内容
【题目】研究NOx、CO2的吸收利用对促进低碳社会的构建和环境保护具有重要意义。
(1)已知:① 2H2(g) + O2(g)=2H2O(g) H1
② CO2(g)+3H2(g)![]() CH3OH (l) + H2O (l) H2
CH3OH (l) + H2O (l) H2
③ H2O(g)![]() H2O(l) H3
H2O(l) H3
求 25℃、101kPa下,2 mol CH3OH (l)完全燃烧的H=_____(用含H1、H2、H3的式子表示)。
(2)向1 L密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) ![]() CH3OH (l) + H2O (l) H2
CH3OH (l) + H2O (l) H2
①已知反应的H2<0,则此反应自发进行的条件是_________(填“低温”、“高温”或“任意温度”)。
②在t2时将容器容积缩小为原体积的一半,t3时再次达到平衡,请画出t2之后 CO2气体的浓度随时间变化的曲线。______________

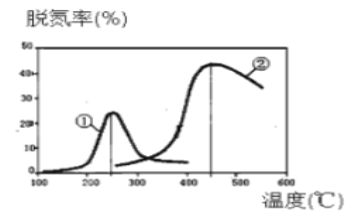
(3)用NH3催化还原NOX可以消除氮氧化物的污染。如下图,采用NH3作还原剂,烟气以一
定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为:NO(g) + NO2(g) + 2NH3(g)![]() 2N2(g) + 3H2O(g)。 以下说法不正确的是__________。(填编号)
2N2(g) + 3H2O(g)。 以下说法不正确的是__________。(填编号)
A.使用第②种催化剂更有利于提高NOx的平衡转化率
B.催化剂①、②分别适合于250℃和450℃左右脱氮
C.相同条件下,改变压强对脱氮率会有影响
D.烟气通过催化剂的流速越快,脱氮效果会越好
(4)用电解法处理NO2是消除氮氧化物污染的新方法,其原理是将NO2在电解池中分解成无污染的N2和O2,电解质是固体氧化物陶瓷(内含O2ˉ离子,可定向移动),阳极的反应式是_________。
【答案】 H=3H1-2H2+4H3 低温 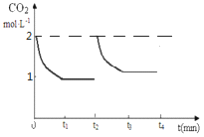 AD 2O2ˉ-4e-= O2↑
AD 2O2ˉ-4e-= O2↑
【解析】(1)①2H2(g)+O2(g)=2H2O(g)△H1,②CO2(g)+3H2(g)CH3OH (l)+H2O (l)△H2,③H2O(g)H2O(l)△H3,依据热化学方程式和盖斯定律计算(①×3-②×2+③×4)×![]() 得到热化学方程式:CH3OH(g)+
得到热化学方程式:CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=
O2(g)=CO2(g)+2H2O(l)△H=![]() (3△H1-2△H2+4△H3),2mol CH3OH (l)完全燃烧的△H=3△H1-2△H2+4△H3;故答案为:3△H1-2△H2+4△H3;
(3△H1-2△H2+4△H3),2mol CH3OH (l)完全燃烧的△H=3△H1-2△H2+4△H3;故答案为:3△H1-2△H2+4△H3;
(2)①CO2(g)+3H2(g)═CH3OH(l)+H2O(l),熵变△S<0,反应焓变△H2<0,低温下满足△H-T△S<0,故答案为:低温;
②保持其他条件不变,在t2时将容器容积缩小一倍,CO2的浓度瞬间增大到原来的2倍,同时压强增大,平衡正向移动,然后CO2的浓度逐渐减小,t3时达到平衡,平衡时浓度比原来大,则t2~t3CO2的浓度随时间的变化如图: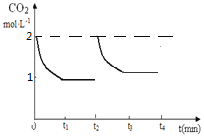 ,故答案为:
,故答案为:  ;
;
(3)A.催化剂不会影响转化率,只影响反应速率,所以第②种催化剂对转化率没有影响,故A错误;B.由图象可知,催化剂①、②分别适合于250℃和450℃左右脱氮,其催化活性最好,故B正确;C.该反应为体积增大的反应,增大压强,平衡向着逆向移动,所以压强对脱氮率有影响,故C正确;D.从题干信息无法判断烟气通过催化剂的流速对脱氮效果的影响,催化剂对转化率没有影响,故D错误;故选AD;
(4)电解法处理氮氧化合物原理是将NOx在电解池中分解成无污染的N2和O2除去,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,阴极发生还原反应,阴极上是NOx获得电子生成N2与O2-,电极反应式为:2NOx+4xe-=N2+2xO2-,阳极上氧离子失去电子生成氧气,电极反应式为2O2ˉ-4e-= O2,故答案为:2O2ˉ-4e-= O2。

 阅读快车系列答案
阅读快车系列答案