��Ŀ����
����Ŀ����O2��HClת��ΪCl2 �� �����Ч�棬������Ⱦ��
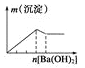
��1����ͳ�ϸ�ת��ͨ����ͼ1��ʾ�Ĵ�ѭ��ʵ�֣����У���Ӧ��Ϊ��2HCl��g��+CuO��s��H2O��g��+CuCl2��s����H1 �� ��Ӧ������1molCl2��g���ķ�Ӧ��Ϊ��H2 �� ���ܷ�Ӧ���Ȼ�ѧ����ʽΪ����Ӧ���á�H1�͡�H2��ʾ���� 
��2������RuO2����������HClת��ΪCl2���ܷ�Ӧ���и��õĴ����ԣ� ��ʵ������һ��ѹǿ�£��ܷ�Ӧ��HClƽ��ת�������¶ȱ仯�Ħ�HCl��T������ͼ2�����ܷ�Ӧ�ġ�H0�����������=����������A��B�����ƽ�ⳣ��K��A����K��B���нϴ���� ��
��������ʵ������ѹ�����ʹѹǿ��������Ӧ��HCl��T���ߵ�ʾ��ͼ������Ҫ˵�����ɣ�
�����д�ʩ�У���������ߦ�HCl���� ��
A������n��HCl�� B������n��O2��
C��ʹ�ø��õĴ��� D����ȥH2O
��3��һ�������²�÷�Ӧ������n��Cl2�����������£�
t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n��Cl2��/10��3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
����2.0��6.0min����HCl�����ʵ����仯��ʾ�ķ�Ӧ���ʣ���molmin��1Ϊ��λ��д��������̣���
��4��Cl2��;�㷺��д����Cl2�Ʊ�Ư�۵Ļ�ѧ��Ӧ����ʽ ��
���𰸡�
��1��4HCl��g��+O2��g��=2Cl2��g��+2H2O��g����H=2����H1+��H2��
��2������ K��A���� 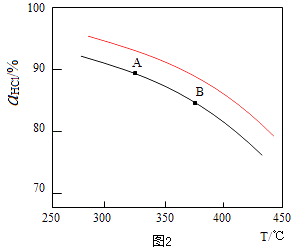 ����ѹǿ,ƽ��������Ӧ�����ƶ�,��HCl����,��ͬ�¶���HCl��ƽ��ת���ʱ�֮ǰʵ��Ĵ� BD
����ѹǿ,ƽ��������Ӧ�����ƶ�,��HCl����,��ͬ�¶���HCl��ƽ��ת���ʱ�֮ǰʵ��Ĵ� BD
��3���⣺�ɱ������ݿ�֪��2.0��6.0min�ڡ�n��Cl2��=��5.4��1.8����10��3mol=3.6��10��3mol������Cl2�����ʵ����仯��ʾ�ķ�Ӧ����v��Cl2��= ![]() =9��10��4molmin��1������֮�ȵ����仯ѧ������֮�ȣ���v��HCl��=2v��Cl2��=1.8��10��3mol��min��1��
=9��10��4molmin��1������֮�ȵ����仯ѧ������֮�ȣ���v��HCl��=2v��Cl2��=1.8��10��3mol��min��1��
��2.0��6.0min����HCl�����ʵ����仯��ʾ�ķ�Ӧ����1.8��10��3molmin��1
��4��2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O
���������⣺��1����ͼʾ��֪����������Ϊ��4HCl+O2=2Cl2+2H2O����Ӧ��Ϊ��2HCl��g��+CuO��s��H2O��g��+CuCl2��s����H1��
��Ӧ������1molCl2��g���ķ�Ӧ��Ϊ��H2����Ӧ�Ȼ�ѧ����ʽΪ��CuCl2��g��+ ![]() O2��g��=CuO��s��+Cl2��g����H2��
O2��g��=CuO��s��+Cl2��g����H2��
���ݸ�˹���ɣ���+�ڣ���2�ɵ��ܷ�Ӧ���Ȼ�ѧ����ʽ��4HCl��g��+O2��g��=2Cl2��g��+2H2O��g����H=2����H1+��H2����
���Դ��ǣ�4HCl��g��+O2��g��=2Cl2��g��+2H2O��g����H=2����H1+��H2������2����ͼ��֪���¶�Խ�ߣ�ƽ��ʱHCl��ת����ԽС��˵�������¶�ƽ�����淴Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ������H��0����ѧƽ�ⳣ����С����K��A����K��B����
���Դ��ǣ�����K��A����������ӦΪ���������С�ķ�Ӧ������ѹǿ��ƽ��������Ӧ�����ƶ�����ͬ�¶���HCl��ƽ��ת���ʱ�֮ǰʵ��Ĵ�ѹ�����ʹѹǿ������Ӧ��HCl��T���ߵ�ʾ��ͼΪ  ��
��
���Դ��ǣ� 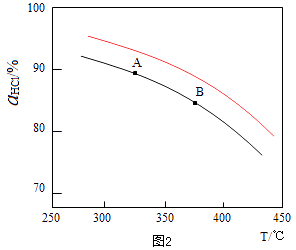 ������ѹǿ��ƽ��������Ӧ�����ƶ�����HCl������ͬ�¶���HCl��ƽ��ת���ʱ�֮ǰʵ��Ĵ�A������n��HCl����HClŨ������ƽ�����ƣ���HCl��ת���ʽ��ͣ���A����
������ѹǿ��ƽ��������Ӧ�����ƶ�����HCl������ͬ�¶���HCl��ƽ��ת���ʱ�֮ǰʵ��Ĵ�A������n��HCl����HClŨ������ƽ�����ƣ���HCl��ת���ʽ��ͣ���A����
B������n��O2��������Ũ������ƽ�����ƣ�HCl��ת������ߣ���B��ȷ��
C��ʹ�ø��õĴ������ӿ췴Ӧ���ʣ����̵���ƽ���ʱ�䣬��Ӱ��ƽ���ƶ���HCl��ת���ʲ��䣬��C����
D����ȥ������H2O��������ƽ�����ƣ�HCl��ת��������D��ȷ��
��ѡ��BD����4���������������Ʒ�Ӧ�����Ȼ��ơ����������ˮ����Ӧ����ʽΪ2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O��
���Դ��ǣ�2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O��
�����㾫�������ջ�ѧƽ��״̬���ʼ������ǽ����ĸ�������Ҫ֪����ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����

����Ŀ������ʵ�����Ӧʾ��ͼ�Ĺ�ϵ��ȷ���� ( )
A | B | C | D |
�� | �� | ��������Һ����εμ� | �����ʯ��ˮ�л���ͨ�� |
|
|
|
|
A. A B. B C. C D. D