题目内容
【题目】根据题意解答
(1)从下列各组反应对比中,判断哪种粒子的氧化性最强,哪种粒子的还原性最强:铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质,则Cu、Fe、Ag中,还原性最强;Cu2+、Fe2+、Ag+中,氧化性最强.
(2)铝与稀硝酸发生反应的化学方程式(未配平)为:Al+HNO3=Al(NO3)3+NO↑+H2O,该反应的氧化剂是(填化学式),配平上述反应,则反应中还原剂与氧化剂的物质的量之比是 , 当有5.4g Al发生反应时,转移电子的物质的量为 , 该反应的离子方程式为: .
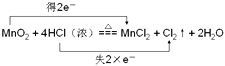
(3)MnO2与浓盐酸共热反应生成MnCl2、Cl2和H2O,写出该反应的化学方程式并用双线桥标出电子转移的方向和数目 .
(4)某一反应体系有反应物和生成物共六种物质:Cu(NO3)2、H2SO4、Cu2S、稀HNO3、H2O和NO,写出该反应的化学方程式 .
【答案】
(1)Fe;Ag+
(2)HNO3;1:1;0.6mol;Al+4H++NO3﹣=Al3++NO↑+2H2O
(3)
(4)3Cu2S+22HNO3(稀)═6Cu(NO3)2+10NO↑+3H2SO4+8H2O
【解析】解:(1)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质,则铁置换出Cu,Cu置换出Ag,所以还原剂Fe>Cu>Ag,故还原性最强的是Fe;Cu2+、Fe2+、Ag+中氧化性强弱为Ag+>Cu2+>Fe2+ , 氧化性最强的是Ag+;所以答案是:Fe;Ag+;(2)已知Al+HNO3=Al(NO3)3+NO↑+H2O,HNO3→NO,氮元素化合价从+5降低为+2,HNO3是氧化剂,1molAl从0价升高为+3价,Al是还原剂,根据得失电子守恒配平方程式为:Al+4HNO3=Al(NO3)3+NO↑+2H2O;
1molAl从0价升高为+3价,失去3mol电子,1molHNO3化合价从+5降低为+2得到3mol电子,所以还原剂与氧化剂的物质的量相等之比是1:1;
n(Al)= ![]() =
= ![]() =0.2mol,所以转移电子的物质的量为0.2mol×3=0.6mol;
=0.2mol,所以转移电子的物质的量为0.2mol×3=0.6mol;
Al和4HNO3反应的离子方程式为Al+4H++NO3﹣=Al3++NO↑+2H2O,
所以答案是:HNO3;1:1;0.6mol;Al+4H++NO3﹣=Al3++NO↑+2H2O;(3)MnO2与浓盐酸共热反应生成MnCl2、Cl2和H2O中锰元素化合价从+4价降低到+2价;得到电子被还原;HCl中的氯元素化合价从﹣1价升高到0价失去电子被氧化;电子转移双线桥标为: 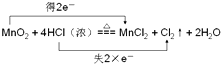 ;
;
所以答案是: 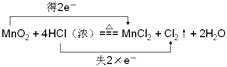 ;(4)反应中稀HNO3具有强氧化性为反应物生成NO,N元素化合价由+5价降低为NO中+2价,共降低3价,Cu2S具有强还原性为反应物生成Cu(NO3)2和H2SO4 , Cu2S中Cu元素化合价由+1价升高为+2价、S元素化合价由﹣2升高为+6,总共升高10价,化合价最小公倍数为30,故Cu2S的系数为3,NO的系数为10,再利用原子守恒,则方程式为:3Cu2S+22HNO3(稀)═6Cu(NO3)2+10NO↑+3H2SO4+8H2O,
;(4)反应中稀HNO3具有强氧化性为反应物生成NO,N元素化合价由+5价降低为NO中+2价,共降低3价,Cu2S具有强还原性为反应物生成Cu(NO3)2和H2SO4 , Cu2S中Cu元素化合价由+1价升高为+2价、S元素化合价由﹣2升高为+6,总共升高10价,化合价最小公倍数为30,故Cu2S的系数为3,NO的系数为10,再利用原子守恒,则方程式为:3Cu2S+22HNO3(稀)═6Cu(NO3)2+10NO↑+3H2SO4+8H2O,
所以答案是:3Cu2S+22HNO3(稀)═6Cu(NO3)2+10NO↑+3H2SO4+8H2O.

【题目】从海水中提取镁是世界各国获得镁的主要来源,以下是制取镁的过程中涉及的几种物质的溶度积,根据你所学的知识回答下列几个问题:
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
溶度积 | 2.8×10-9 | 6.8×10-6 | 5.5×10-6 | 1.8×10-11 |
(1)在从海水中提取镁时,往往用到贝壳(主要成份是碳酸钙),你认为____(填“能”或“不能”)将贝壳研磨成粉末直接投入海水中,理由是____;如果不能直接投入,应将贝壳作何处理____,试写出化学方程式_______。
(2)某同学在实验室条件下模拟该生产过程,但实验室无石灰,他打算用烧碱代替,你认为_______(填“可以”或“不可以”)得到Mg(OH)2。在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他___(填“能”或“不能”)将Mg2+转化为Mg(OH)2沉淀,理由是________。(用离子方程式表示)
(3)已知海水中镁离子浓度为1.8×10-3mol/L,则要使镁离子产生沉淀,溶液的pH最低应为___。