题目内容
在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)  CO2(g)+H2(g)
△H<0
CO2(g)+H2(g)
△H<0
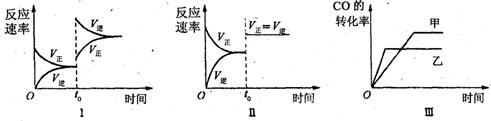
下列分析中不正确的是
A、图Ⅰ研究中的是t0时升高温度对反应速率的影响
B、图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C、图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D、图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
【答案】
C
【解析】A项:升温,υ正、υ逆均增大;△H<0说明正向为放热反应,而升温平衡向吸热反应方向移动即该反应的逆向,所以在t0时刻υ逆>υ正,平衡发生移动,然后达新平衡,A正确;
B项,增大压强(缩小体积)或使用催化剂,υ正、υ逆均增大;但平衡不会移动,故B正确;
C项,因催化剂仅加快反应速率,但不影响平衡移动,即甲、乙达平衡时CO的转化率应相等,故C错误;
D项,乙达平衡用时短,说明反应速率快,即所处的温度高;升温平衡向吸热反应方向移动即该反应的逆向,也就是说,温度越高CO的转化率越低,故D正确

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
从下列实验事实所引出的相应结论正确的是( )
|