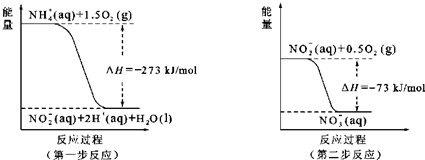
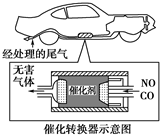
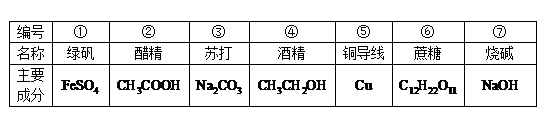题目内容
(1)在反应2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O中,还原剂是______.
(2)反应:KCN+H2O2+H2O═A+NH3↑(已配平),则生成物A的化学式为______,H2O2被称为“绿色氧化剂”的理由是______.
(3)浓盐酸在反应KClO3+HCl-→KCl+ClO2+Cl2+______(补充完整)中显示出来的性质是______.
(4)在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1molCr3+反应所需PbO2的物质的量为______.
(2)反应:KCN+H2O2+H2O═A+NH3↑(已配平),则生成物A的化学式为______,H2O2被称为“绿色氧化剂”的理由是______.
(3)浓盐酸在反应KClO3+HCl-→KCl+ClO2+Cl2+______(补充完整)中显示出来的性质是______.
(4)在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1molCr3+反应所需PbO2的物质的量为______.
(1)2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O中,Br元素的化合价升高,则HBr为还原剂,故答案为:HBr;
(2)由原子守恒可知A的化学式为KHCO3,H2O2被称为“绿色氧化剂”,其还原产物为水,H2O没有污染性,故答案为:KHCO3;还原产物为水,H2O没有污染性;
(3)由原子守恒可知还生成的产物为H2O,反应中生成KCl为盐类物质,生成氯气时HCl中Cl元素的化合价升高,表现其还原性,故答案为:H2O;酸性和还原性;
(4)氧化还原反应,得失电子守恒,则设所需PbO2的物质的量为x,由电子守恒得1mol×(6-3)=x×(4-2),解得x=1.5mol,故答案为:1.5mol.
(2)由原子守恒可知A的化学式为KHCO3,H2O2被称为“绿色氧化剂”,其还原产物为水,H2O没有污染性,故答案为:KHCO3;还原产物为水,H2O没有污染性;
(3)由原子守恒可知还生成的产物为H2O,反应中生成KCl为盐类物质,生成氯气时HCl中Cl元素的化合价升高,表现其还原性,故答案为:H2O;酸性和还原性;
(4)氧化还原反应,得失电子守恒,则设所需PbO2的物质的量为x,由电子守恒得1mol×(6-3)=x×(4-2),解得x=1.5mol,故答案为:1.5mol.

练习册系列答案
相关题目