题目内容
【题目】 (1)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。完成下列填空:
①As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体. 若As2S3和SnCl2恰好完全反应,As2S3和SnCl2的物质的量之比为_______.该反应的氧化剂是_____,反应产生的气体可用_______吸收.
②As2S3和HNO3有如下反应:__As2S3+__NO3-+_____=__H3AsO4+__S+__NO2↑+_______
A.将方程式补充完整并配平
B.若生成1 mol H3AsO4,则反应中转移电子的物质的量为________.
(2)某温度下将Cl2通入KOH溶液中,反应后得到KCl,KClO和KClO3的混合溶液,经测定ClO-和![]() 的物质的量浓度之比为7:1,则Cl2与KOH反应时,氧化剂和还原剂物质的量之比为___.若5mol Cl2参加反应,转移电子数为______________(用NA表示阿伏伽德罗常数)
的物质的量浓度之比为7:1,则Cl2与KOH反应时,氧化剂和还原剂物质的量之比为___.若5mol Cl2参加反应,转移电子数为______________(用NA表示阿伏伽德罗常数)
(3)某一反应体系中有反应物和生成物共五种物质:S,H2S,HNO3,NO,H2O. 该反应的化学方程式为______________________;若反应过程中转移了0.3mol电子,则氧化产物的质量是______g;
【答案】1:1 As2S3 氢氧化钠溶液或硫酸铜溶液 1 10 10 H+ 2 3 10 2 H2O(补充方程式和配平各1分) 5 mol 3:2 6NA 3H2S+2HNO3=3S+2NO↑+4H2O 4.8
【解析】
(1)①As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体,反应的方程式为2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑,可根据方程式或化合价的变化判断;反应中As和Sn元素化合价发生变化,根据化合价的变化判断氧化剂和还原剂等概念;
②A.结合电子守恒、电荷守恒和原子守恒配平反应方程式;
B.若生成1 mol H3AsO4,参加反应的As2S3物质的量为0.5mol,反应中As元素从+3价升高为+5价,S元素从-2价升高为+6价;
(2) Cl2生成ClO-与ClO3-是被氧化的过程,Cl2生成KCl是被还原的过程,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,根据ClO-与ClO3-的物质的量浓度之比可计算失去电子的总物质的量,进而可计算得到电子的总物质的量,可计算被还原的氯元素的物质的量,则可计算被还原的氯元素和被氧化的氯元素的物质的量之比;
(3) H2S具有还原性,HNO3具有氧化性,二者发生氧化还原反应。
(1)①根据电子得失守恒知1molAs2S3作氧化剂得到2mol电子,而1molSnCl2作还原剂失去2mol电子,所以二者的物质的量之比是1:1;反应中As元素化合价降低,As2S3为氧化剂,H2S为酸性气体,可用NaOH溶液吸收;
②A.As元素化合价由+3价升高到+5价,S元素化合价由-2价升高到0价,N元素化合价由+5降低为+4,反应中NO3-发生还原反应生成NO2,由守恒法得反应方程式为As2S3+10NO3-+10H+=2H3AsO4+3S+10NO2↑+2H2O;
B.若生成1 mol H3AsO4,参加反应的As2S3物质的量为0.5mol,反应中As元素从+3价升高为0价,S元素从-2价升高为+6价,则反应中转移电子的物质的量为0.5mol×(2×2+2×3)=5mol;
(2) Cl2生成ClO-与ClO3-是被氧化的过程,化合价分别由0价升高为+1价和+5价,ClO-与ClO3-的物质的量浓度之比为7:1,则可设ClO-为7mol,ClO3-为1mol,被氧化的Cl共为8mol,失去电子的总物质的量为7mol×(1-0)+1mol×(5-0)=12mol,根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等,Cl2生成KCl是被还原的过程,化合价由0价降低为-1价,则得到电子的物质的量也应为12mol,则被还原的Cl的物质的量为12mol,所以被还原的氯元素和被氧化的氯元素的物质的量之比为12mol:8mol=3:2;若5mol Cl2参加反应,其中被还原的Cl2的物质的量为5mol ×![]() =3mol,则转移电子的物质的量为3mol×2=6mol,转移电子数为6NA;
=3mol,则转移电子的物质的量为3mol×2=6mol,转移电子数为6NA;
(3) H2S具有还原性,HNO3具有氧化性,二者发生氧化还原反应为3H2S+2HNO3=3S+2NO↑+4H2O,S元素的化合价升高,转移6mol电子生成3mol氧化产物S,则反应过程中转移了0.3mol电子,则氧化产物的质量是0.3mol×![]() ×32g/mol=4.8g。
×32g/mol=4.8g。

 阅读快车系列答案
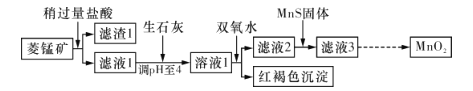
阅读快车系列答案【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、 Cu2 (OH)2 CO3等杂质]为原料制取二氧化锰.其工艺流程示意图如下图所示:
已知生成氢氧化物沉淀的pH如下表所示:
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度均为0.1mol·L—1
请回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是__________;盐酸溶解MnCO3的化学方程式是____________________________。
(2)向溶液1中加入双氧水时.发生反应的离子方程式是_________________。
(3)向滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,发生反应的离子方程式是_________________________。
(4)将MnCl2转化为MnO2的一种方法是氧化法。其具体做法是用酸化的NaClO3溶液将MnCl2氧化,请完成该反应的离子方程式:5Mn2++2ClO3—+____===____+_____+_____。
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是______________________。
②若在上述MnO2溶液中加入一定量的Mn(NO3 )2粉末.则无Cl2产生.其原因是______。