题目内容
某元素M的单质1.8g在过量的O2中充分燃烧,得到M2O33.4g,已知M原子核外电子数比核内中子数少1。该元素在周期表中的位置是( )
| A.第2周期ⅢA族 | B.第2周期ⅥA族 | C.第3周期ⅤA族 | D.第3周期ⅢA族 |
D
根据氧化物的化学式可知,M的化合价是+3价。根据质量守恒定律可知,消耗乙炔是3.4g-1.8g=1.6g,转移电子是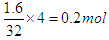 。所以金属的相对原子质量是1.8×3÷0.2=27。又因为M原子核外电子数比核内中子数少1,所以质子数是13,即是铝元素。答案选D。
。所以金属的相对原子质量是1.8×3÷0.2=27。又因为M原子核外电子数比核内中子数少1,所以质子数是13,即是铝元素。答案选D。
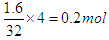 。所以金属的相对原子质量是1.8×3÷0.2=27。又因为M原子核外电子数比核内中子数少1,所以质子数是13,即是铝元素。答案选D。
。所以金属的相对原子质量是1.8×3÷0.2=27。又因为M原子核外电子数比核内中子数少1,所以质子数是13,即是铝元素。答案选D。
练习册系列答案
相关题目