题目内容
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下:
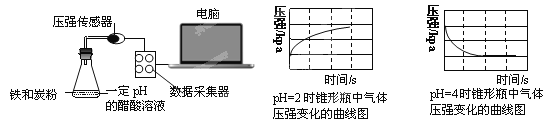
分析图像,以下结论错误的是
A.溶液pH≤2时,生铁发生析氢腐蚀
B.生铁的腐蚀中化学腐蚀比电化学腐蚀更普遍
C.在酸性溶液中生铁可能发生吸氧腐蚀
D.两溶液中负极反应均为:Fe – 2e-===Fe2+
【答案】B
【解析】
试题分析:A.根据PH=2的溶液中压强与时间的关系知,压强随着反应的进行而逐渐增大,说明该装置发生析氢腐蚀,则溶液pHpH≤2时,生铁发生析氢腐蚀,故A正确;B.生铁的腐蚀中电化学腐蚀比化学腐蚀更普遍,错误; C.pH=4的醋酸溶液中压强随着反应的进行而逐渐减小,说明发生吸氧腐蚀,pH=4的醋酸溶液呈酸性,所以在酸性溶液中生铁可能发生吸氧腐蚀,正确;D.两个溶液中都发生电化学腐蚀,铁均作负极,电极反应式为Fe-2e-=Fe2+,故D正确;故选B.

 步步高达标卷系列答案
步步高达标卷系列答案【题目】研究催化剂对化学反应有重要意义。为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
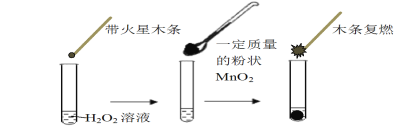
(1)甲同学欲用上图所示实验来证明MnO2是H2O2分解反应的催化剂,写出该反应的化学方程式 。
(2)为探究MnO2的质量对催化效果的影响,乙同学分别量取50 mL 1% H2O2加入容器中,在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如下:
MnO2的质量/g | 0.1 | 0.2 | 0.4 |
40s末O2体积/mL | 49 | 61 | 86 |
由此得出的结论是 。
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10 mL 5% H2O2 ) :
试管 | Ⅰ | Ⅱ | Ⅲ |
滴加试剂 | 5滴0.1 mol·L-1 FeCl3 | 5滴0.1 mol·L-1 CuCl2 | 5滴0.3 mol·L-1 NaCl |
产生气 泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
结论是 ,实验Ⅲ的目的是 。
(4)查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和 。