题目内容
 (2011?湖南二模)(1)已知可逆反应:M(g)+N(g)
(2011?湖南二模)(1)已知可逆反应:M(g)+N(g) P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:①在某温度下,反应物的起始浓度分别为:c(M)=1mol?L-1,c(N)=2.4mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为
25%
25%
.此反应的化学平衡常数K=0.5
0.5
.②若反应温度不变,反应物的起始浓度分别为:c(M)=4mol?L-1,c(N)=amol?L-1;达到平衡后,c(P)=2mol?L-1’a=
6
6
mol?L-1.(2)随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.
①有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是:
A.CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H=+49.0kJ/mol
B.CH3OH(g)+3/O2(g)═CO2(g)+2H2O(g);△H=-676.7kJ/mol
由上述方程式可知,CH3OH的燃烧热
大于
大于
(填“大于”、“等于”或“小于”)676.7kJ/mol.已知水的气化热为44kJ/mol则氢气燃烧的热化学方程式为H2(g)+
O2(g)═H2O(l);△H=-285.9kJ/mol
| 1 |
| 2 |
H2(g)+
O2(g)═H2O(l);△H=-285.9kJ/mol
| 1 |
| 2 |
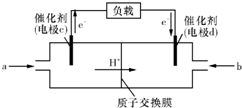
②图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图.甲醇在催化剂作用下提供质子和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH(g)+3O2═2CO2+4H2O.则c电极是
负极
负极
(填“正极”或“负极”),c电极上发生的电极反应是CH3OH-6e-=CO2+6H+
CH3OH-6e-=CO2+6H+
.分析:(1)①根据方程式利用三段式法计算转化率,根据K=
计算平衡常数;
②利用三段式法结合温度不变平衡常数不变来计算;
(2)①利用盖斯定律计算反应热;
②原电池中电子从负极经外电路流向正极,负极发生氧化反应.
| c(P)?c(Q) |
| c(M)?c(N) |
②利用三段式法结合温度不变平衡常数不变来计算;
(2)①利用盖斯定律计算反应热;
②原电池中电子从负极经外电路流向正极,负极发生氧化反应.
解答:解:(1)①由方程式可知,M转化的物质的量浓度为1mol/L×60%=0.6mol/L,
M(g)+N(g) P(g)+Q(g)
P(g)+Q(g)
起始:1mol/L 2.4mol/L 0 0
转化:0.6mol/L 0.6mol/L 0.6mol/L 0.6mol/L
平衡:0.4mol/L 1.8mol/L 0.6mol/L 0.6mol/L
则N反应的量是0.6 mol/L,所以N的转化率为
×100%=25%,
K=
=
=0.5,
故答案为:25%;0.5;
②M(g)+N(g) P(g)+Q(g)
P(g)+Q(g)
起始Ⅰ:1 2.4 0 0
平衡Ⅰ:0.4 1.8 0.6 0.6
起始Ⅱ:4 a 0 0
平衡Ⅱ:2 a-2 2 2
平衡Ⅰ和平衡Ⅱ温度相同,则K值相同,
则
=
,
解之得:a=6
故答案为:6;
(2)①气态水液化为液态水要放热,根据燃烧热概念可知,生成稳定的氧化物应为液态水,所以CH3OH的燃烧热大于676.7kJ/mol,
已知:①CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H=+49.0kJ/mol
②CH3OH(g)+3/O2(g)═CO2(g)+2H2O(g);△H=-676.7kJ/mol
③H2O(l)=H2O(g);△H=+44kJ/mol
利用盖斯定律,将
-③可得:
H2(g)+
O2(g)═H2O(l);△H=-285.9kJ/mol,
故答案为:大于;H2(g)+
O2(g)═H2O(l);△H=-285.9kJ/mol;
②原电池中电子从负极经外电路流向正极,根据电子转移的方向可知c为负极,负极发生氧化反应,电极反应式为
CH3OH-6e-=CO2+6H+,
故答案为:负极;CH3OH-6e-=CO2+6H+.
M(g)+N(g)
 P(g)+Q(g)
P(g)+Q(g)起始:1mol/L 2.4mol/L 0 0
转化:0.6mol/L 0.6mol/L 0.6mol/L 0.6mol/L
平衡:0.4mol/L 1.8mol/L 0.6mol/L 0.6mol/L
则N反应的量是0.6 mol/L,所以N的转化率为
| 0.6mol/L |
| 2.4mol/L |
K=
| c(P)?c(Q) |
| c(M)?c(N) |
| 0.6mol/L×0.6mol/L |
| 0.4mol/L×1.8mol/L |
故答案为:25%;0.5;
②M(g)+N(g)
 P(g)+Q(g)
P(g)+Q(g)起始Ⅰ:1 2.4 0 0
平衡Ⅰ:0.4 1.8 0.6 0.6
起始Ⅱ:4 a 0 0
平衡Ⅱ:2 a-2 2 2
平衡Ⅰ和平衡Ⅱ温度相同,则K值相同,
则
| 2×2 |
| 2×(a-2) |
| 0.6×0.6 |
| 0.4×1.8 |
解之得:a=6
故答案为:6;
(2)①气态水液化为液态水要放热,根据燃烧热概念可知,生成稳定的氧化物应为液态水,所以CH3OH的燃烧热大于676.7kJ/mol,
已知:①CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H=+49.0kJ/mol
②CH3OH(g)+3/O2(g)═CO2(g)+2H2O(g);△H=-676.7kJ/mol
③H2O(l)=H2O(g);△H=+44kJ/mol
利用盖斯定律,将
| ②-① |
| 3 |
H2(g)+
| 1 |
| 2 |
故答案为:大于;H2(g)+
| 1 |
| 2 |
②原电池中电子从负极经外电路流向正极,根据电子转移的方向可知c为负极,负极发生氧化反应,电极反应式为
CH3OH-6e-=CO2+6H+,
故答案为:负极;CH3OH-6e-=CO2+6H+.
点评:本题考查较为综合,涉及化学平衡的计算,化学反应与能量以及原电池知识,题目难度较大,注意平衡常数的计算和应用,把握盖斯定律的运用.

练习册系列答案
相关题目
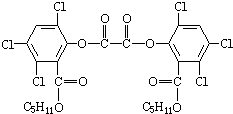 (2011?湖南二模)2011年3月3日晚联合国教科文组织在其巴黎总部举行世界杰出女科学家奖颁奖仪式.香港大学无机化学教授任咏华,她因在发光材料和太阳能创新技术方面取得突出成就而获奖.她主要研究无机发光材料,“魔棒”是一种有机发光材料,“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如下.下列有关说法正确的是( )
(2011?湖南二模)2011年3月3日晚联合国教科文组织在其巴黎总部举行世界杰出女科学家奖颁奖仪式.香港大学无机化学教授任咏华,她因在发光材料和太阳能创新技术方面取得突出成就而获奖.她主要研究无机发光材料,“魔棒”是一种有机发光材料,“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如下.下列有关说法正确的是( )