题目内容
(2011?湖南二模)短周期元素X、Y、Z、W原子序数依次增大.已知W与X原子最外层都只有1个S电子,二者电子层数之差为2;Y原子最外层S电子与P电子数相等,其电子层数与内层电子数相等;Z原子S电子与P电子数相等.
(1)Z原子的电子排布式为
(2)X与Y两种元素构成的最简单的化合物分子的空间构型是
(3)Z与W以原子个数比1:1形成的化合物的化学式是
(4)X与Z形成的化合物X2Z的结构式为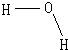
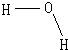 ,该物质的沸点比较高,其主要原因是
,该物质的沸点比较高,其主要原因是
(1)Z原子的电子排布式为
1s22s22p4
1s22s22p4
.(2)X与Y两种元素构成的最简单的化合物分子的空间构型是
正四面体
正四面体
结构,这种结构的分子中的中心原子一般采用sp3
sp3
杂化轨道形成化学键.由X和Y形成的化合物Y2X2分子的共价键有3
3
个σ键和2
2
个π键.(3)Z与W以原子个数比1:1形成的化合物的化学式是
Na2O2
Na2O2
,该化合物固态时属于离子
离子
晶体,形成该晶体的化学键有离子键、共价键
离子键、共价键
.(4)X与Z形成的化合物X2Z的结构式为
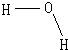
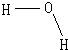
H2O分子之间存在氢键作用
H2O分子之间存在氢键作用
.分析:短周期元素X、Y、Z、W原子序数依次增大,W与X原子最外层都只有1个S电子,二者电子层数之差为2,即都在ⅠA族,X为H,W为Na;Y原子最外层S电子与P电子数相等,其电子层数与内层电子数相等,则Y的电子排布为1s22s22p2,则Y为C;Z原子S电子与P电子数相等,则Z为第二周期元素,S电子共4个,则P电子为4,即Z为O,以此来解答.
解答:解:短周期元素X、Y、Z、W原子序数依次增大,W与X原子最外层都只有1个S电子,二者电子层数之差为2,即都在ⅠA族,X为H,W为Na;Y原子最外层S电子与P电子数相等,其电子层数与内层电子数相等,则Y的电子排布为1s22s22p2,则Y为C;Z原子S电子与P电子数相等,则Z为第二周期元素,S电子共4个,则P电子为4,即Z为O
(1)Z为O,其质子数为8,电子排布式为1s22s22p4,
故答案为:1s22s22p4;
(2)X与Y两种元素构成的最简单的化合物为甲烷,空间构型为正四面体,C原子上没有孤对电子,σ键数为4,则C原子采取sp3杂化,C2H2中存在碳碳三键和碳氢单键,则有3个σ键,2个π键;
故答案为:正四面体;sp3;3;2;
(3)Z与W以原子个数比1:1形成的化合物为过氧化钠,其化学式为Na2O2,构成微粒为离子,为离子晶体,该物质中O、O之间以共价键结合,离子之间以离子键结合,
故答案为:Na2O2;离子;离子键、共价键;
(4)X与Z形成的化合物为H2O,其结构式为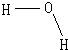 ,因H2O分子之间存在氢键,则沸点比较高,
,因H2O分子之间存在氢键,则沸点比较高,
故答案为: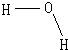 ;H2O分子之间存在氢键作用.
;H2O分子之间存在氢键作用.
(1)Z为O,其质子数为8,电子排布式为1s22s22p4,
故答案为:1s22s22p4;
(2)X与Y两种元素构成的最简单的化合物为甲烷,空间构型为正四面体,C原子上没有孤对电子,σ键数为4,则C原子采取sp3杂化,C2H2中存在碳碳三键和碳氢单键,则有3个σ键,2个π键;
故答案为:正四面体;sp3;3;2;
(3)Z与W以原子个数比1:1形成的化合物为过氧化钠,其化学式为Na2O2,构成微粒为离子,为离子晶体,该物质中O、O之间以共价键结合,离子之间以离子键结合,
故答案为:Na2O2;离子;离子键、共价键;
(4)X与Z形成的化合物为H2O,其结构式为
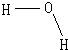 ,因H2O分子之间存在氢键,则沸点比较高,
,因H2O分子之间存在氢键,则沸点比较高,故答案为:
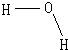 ;H2O分子之间存在氢键作用.
;H2O分子之间存在氢键作用.点评:本题考查物质结构与性质,明确原子的电子排布式中S、P电子时解答本题的关键,并熟悉分子构型、杂化、化学键等知识来解答.

练习册系列答案
相关题目
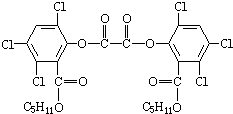 (2011?湖南二模)2011年3月3日晚联合国教科文组织在其巴黎总部举行世界杰出女科学家奖颁奖仪式.香港大学无机化学教授任咏华,她因在发光材料和太阳能创新技术方面取得突出成就而获奖.她主要研究无机发光材料,“魔棒”是一种有机发光材料,“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如下.下列有关说法正确的是( )
(2011?湖南二模)2011年3月3日晚联合国教科文组织在其巴黎总部举行世界杰出女科学家奖颁奖仪式.香港大学无机化学教授任咏华,她因在发光材料和太阳能创新技术方面取得突出成就而获奖.她主要研究无机发光材料,“魔棒”是一种有机发光材料,“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如下.下列有关说法正确的是( )